Preliminary study on the value and safety of templated lymph node dissection in upper urinary tract urothelial carcinoma
-
摘要: 目的 初步研究模板化淋巴结清扫术(lymph node dissection,LND)在上尿路尿路上皮癌(upper tract urothelial carcinoma,UTUC)中的价值及安全性。方法 回顾性分析我院2016年9月—2022年6月行腹腔镜下根治性肾输尿管切除术(laparoscopic radical nephroureterectomy,LRNU)且术后病理证实为UTUC患者的临床和随访资料,根据是否行LND,将患者分为LND组和NLND组,检验并比较2组患者的临床特征、总生存率及无复发生存率,分析肿瘤结局的影响因素。结果 2组患者在术中出血量、手术时长、住院费用及术后Ⅱ级并发症方面差异有统计学意义(P < 0.05);LND组的累积生存率(68.5% vs 55.1%,P=0.077)及无复发生存率(82.1% vs 58.9%,P=0.024)均高于NLND组;在≥pT2期患者中2组累积生存率及无复发生存率分别为67.5% vs 45.4%(P=0.063)和79.9% vs 50.4%(P=0.017);在cN0期患者中,2组累积生存率及无复发生存率分别为71.9% vs 65.6%(P=0.26)和86.3% vs 69.2%(P=0.12)。术后挽救性治疗(HR=0.31,95%CI:0.11~0.86,P=0.024)是改善生存结局的独立保护性因素。结论 UTUC患者,尤其是≥pT2期患者,可能从模板化LND中获益,同时,模板化LND的部分手术相关指标也可能稍逊色于NLND,但总体安全。Abstract: Objective To study the value and safety of templated lymph node dissection(LND) in upper urinary tract urothelial carcinoma(UTUC).Methods Clinical and follow-up data of patients who underwent laparoscopic radical nephroureterectomy(LRNU) and were pathologically confirmed as UTUC in our hospital from September 2016 to June 2022 were retrospectively collected. The patients were divided into LND group and NLND group, and the clinical characteristics, overall survival rate and recurrence-free survival rate of the two groups were examined and compared. The influencing factors of tumor outcome were analyzed.Results There were statistical differences in intraoperative blood loss, operation duration, hospitalization costs and postoperative Ⅱ complications between the two groups(P < 0.05). The cumulative and relapse-free survival rates in the LND group were 68.5% vs 55.1%(P=0.077) and 82.1% vs 58.9%(P=0.024) in all patients compared with the NLND group. In patients with ≥pT2, 67.5% vs 45.4%(P=0.063) and 79.9% vs 50.4%(P=0.017) were found, while in cN0 patients, 71.9% vs 65.6%(P=0.26) and 86.3% vs 69.2%(P=0.12) were found respectively. Postoperative salvage therapy(HR=0.31, 95%CI: 0.11-0.86, P=0.024) was an independent protective factor for improved survival outcomes.Conclusion Templated LND is basically safe for patients with UTUC especially those with ≥pT2, so these patients may benefit from it. However, some operation-related indicators of templated LND may be slightly lower than those of NLND.
-
上尿路尿路上皮癌(upper tract urothelial carcinoma,UTUC)易早期发生淋巴结转移(lymph node metastasis,LNM),恶性程度高,预后差。我国发病率远高于西方国家,UTUC可占到尿路上皮癌的29.9%[1]。近年,各大指南均强调行根治性肾输尿管切除术(radical nephroureterectomy,RNU)时,同期行淋巴结清扫术(lymphy node dissection,LND)的必要性。但实际工作中开展仍然较少,且LND模式不统一,截至2016年底仅36%的患者接受了LND,其中仅40.7%的患者施行了较为充分的LND[2]。LND之所以不被普遍接受,可能是因为与LND的价值相比,LND的围术期安全性和并发症更令人担忧。我们前期已初步证实了模板化LND的价值,但样本量小且随访时间短[3],本文将进一步深入研究。
1. 资料与方法
1.1 临床资料
回顾性收集我院2016年9月—2022年6月期间行腹腔镜下根治性肾输尿管切除术(laparoscopic radical nephroureterectomy,LRNU)并膀胱袖状切除术患者共74例,其中LND 29例,5例为机器人手术,所有LND均按照“Kondo模式”施行[4],与“Kondo模式”主要基于开放式手术不同的是,我们的所有病例均为腔镜手术,甚至有机器人辅助手术,与之相比,具有创伤小、恢复快等优势。未行LND(NLND)者45例,无机器人手术。对于LND患者,统计切除的阳性淋巴结(lymph nody,LN)数量和LN总数,以及LN的解剖位置分布情况。
1.2 清扫方法
“Kondo模式”:肾盂肿瘤清扫肾门水平至肠系膜下动脉起始水平之间的同侧肾门LN、右侧清扫腔静脉旁及腔静脉后LN,左侧清扫主动脉旁及主动脉腔静脉间LN;上中段输尿管肿瘤(跨髂总动脉水平以上)清扫肾门水平至髂总动脉分叉水平之间的同侧上述区域;下段输尿管肿瘤(跨髂总动脉水平以下)清扫同侧盆腔LN(包括髂总、髂外、髂内、闭孔、骶前LN)。
1.3 纳入与排除标准
纳入标准:①术前检查提示UTUC,无远转移,有手术指征,手术方式为RNU+膀胱袖状口切除术的患者;②术后病理证实为尿路上皮癌;③术后能定期返院复查,资料完整的患者。排除标准:①双侧肿瘤;②合并其他恶性肿瘤患者,包括膀胱癌;③术前已行辅助放化疗及免疫治疗患者。
术后3、6、12个月,以后每半年电话告知患者返院复查肾功能、胸腹增强CT及膀胱镜,必要时行核素扫描、MRI或PET-CT检查,外院复查患者通过电话指导微信获取资料。复发/转移患者予基于铂类联合化疗(吉西他滨+顺铂/卡铂)及免疫检查点药物(替雷利珠单抗)辅助治疗,部分行放疗。随访以患者死亡为终点或时间截止到2022年11月31日。
1.4 统计学方法
采用4.0.2版本R软件处理数据。计量资料根据是否服从正态分布采用 X±S或M(Q1,Q3),分别采用t检验或秩和检验进行比较;有序分类资料使用秩和检验,一般分类资料使用χ2检验或者Fisher精确概率法进行组间差异性检验;Cox比例风险回归模型分析多种临床因素与总生存率(overall survival,OS)之间的关系;Kaplan-Meier生存曲线比较LND组和NLND组无复发生存率(recurrence-free survival,RFS)和OS的差异,Log-rank检验2组的差异有无统计学意义。以P < 0.05为差异有统计学意义。
2. 结果
所有患者中位随访时间19个月,其中LND组16个月,NLND组24个月,2组在随访时间上差异无统计学意义。随访期内LND组10例(34.48%)复发,6例(20.7%)为膀胱内复发(intravesical recurrence,IVR);3例(10.34%)死于肿瘤,平均死亡时间为(17.67±14.06)个月;26例(89.66%)存活,平均生存时间(19.50±12.62)个月;带瘤生存7例(24.14%),平均带瘤生存时间为(9.64±16.50)个月。NLND组21例(46.67%)复发,12例(26.67%)为IVR;17例(37.78%)死于肿瘤,平均死亡时间为(13.91±9.93)个月;28例(62.22%)存活,平均生存时间(36.34±18.65)个月,4例(8.9%)带瘤生存,平均带瘤生存时间为(11.75±6.43)个月。见表 1。
表 1 2组患者的临床及随访资料例,M(Q1,Q3) 项目 LND组(29例) NLND组(45例) χ2/Z P值 性别 0.76 0.383 男 18 22 女 11 23 年龄/岁 64.00(60.00, 67.00) 68.00(62.00, 73.00) 1.40 0.163 ECOG(体力状况评分) — 0.311 0 17 18 1 9 20 2 3 7 侧别 0 1 左 15 22 右 14 23 肿瘤位置 0.10 0.754 肾盂 18 25 输尿管 11 20 危险度分级 0.09 0.758 低危 6 12 高危 23 33 cN分期 <0.001 1 cN0 24 37 cN+ 5 8 术中出血量/mL 150.00(100.00, 200.00) 100.00(50.00, 100.00) -3.36 0.001 手术时间/min 305.00(270.00, 380.00) 235.00(190.00, 286.00) -3.74 < 0.001 术后并发症Clavie分级 — 0.042 0~1 22 42 2 7 3 术后住院时间/d 8.00(7.00, 13.00) 8.00(7.00, 10.00) -1.17 0.242 住院费用/元 35 017.38(31 146.18, 43 445.49) 28 946.73(25 082.60, 36 052.19) -2.97 0.003 病理分级 0 1 低级别 13 19 高级别 16 26 pT分期 0.74 0.388 pTis~pT1 5 13 pT2~pT4 24 32 pN分期 58.89 <0.001 pN0 20 0 pNx 0 39 pN+ 9 6 挽救性治疗 0 1 是 8 12 否 21 33 IVR 0.09 0.758 是 6 12 否 23 33 肿瘤复发 0.63 0.426 是 10 21 否 19 24 肿瘤性死亡 5.41 0.020 是 3 17 否 26 28 随访时间/月 16.00(10.00, 26.00) 24.00(12.00, 42.00) 1.78 0.074 以OS为生存结局,将病理分级、肿瘤T/N分期、LND及术后挽救性治疗等临床中可能影响肿瘤预后的临床因素依次纳入单因素Cox回归模型,为避免遗漏相关预后因素,单因素P值≤0.1均纳入多因素Cox回归模型中进一步分析,结果发现术后挽救性治疗(HR=0.31,95%CI:0.11~0.86,P=0.024)是改善生存结局的独立保护性因素,见表 2。
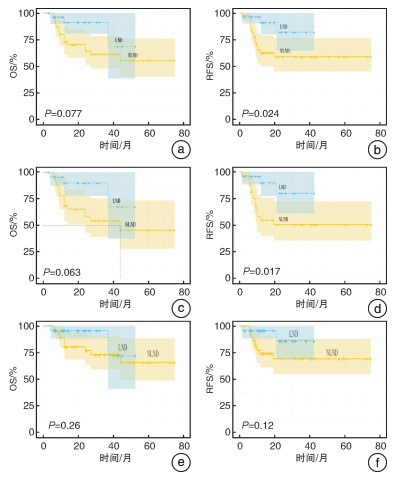
表 2 影响患者术后生存的单因素和多因素Cox回归模型分析结果因素 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 病理分级 低级别a)/高级别 3.88(1.13~13.29) 0.031 4.97(0.98~25.12) 0.053 肿瘤T分期 pTis~pT1a)/pT2~pT4 2.70(0.63~11.67) 0.183 肿瘤N分期 pN0a)/pNx、pN+ 0.29(0.07~1.26) 0.098 0.63(0.05~7.36) 0.712 LND/NLNDa) 0.35(0.10~1.19) 0.091 0.62(0.07~5.23) 0.66 挽救性治疗 有/无a) 0.27(0.11~0.65) 0.004 0.31(0.11~0.86) 0.024 注:a)表示参照组。 分别以OS和RFS为生存结局,LND为分组变量,根据病理T分期及临床N分期进行分层,绘制Kaplan-Meier曲线。结果发现LND组的累积OS与RFS均高于NLND组,在所有患者中分别为68.5% vs 55.1%(P=0.077)和82.1% vs 58.9%(P=0.024);在≥pT2期患者中分别为67.5% vs 45.4%(P=0.063)和79.9% vs 50.4%(P=0.017);在cN0期患者中分别为71.9% vs 65.6%(P=0.26)和86.3% vs 69.2%(P=0.12)。见图 1。
3. 讨论
UTUC早期即可发生LNM,且随T分期的增加,LNM率升高。Nazzani等[5]报道(2 098例,均行LND)的LNM率高达33.0%,其中,pT1、pT2、pT3和pT4期的LNM率分别为9.6%、18.0%、38.7%和63.9%。Huang等[6]前瞻性报道了上海20.5%(8例)的LNM率,其中1例发生在pT1期。本研究中,29例LND患者有9例(31.0%)发生LNM,均在≥pT2期患者中。尽管后两项研究样本量偏小,但LNM率的统计均在LND患者中进行,较为可靠。而研究表明,LNM是预后不良的重要影响因素,LNM患者死于UTUC的概率是非LNM患者的2.6倍[7],其5年的生存率仅为10%~30%[8]。
常规影像学检查对UTUC患者的N分期诊断准确性较低[9],本研究中LND组的9例LNM患者术前仅检出5例,NLND组中的2例非LNM患者则误诊为LNM,因此,精确的N分期依赖于LND的施行。除分期优势外,鉴于UTUC的高LNM率及LNM患者的高死亡率,LND还应有潜在的治疗优势。本研究中,Cox比例回归模型分析显示,LND并非OS的独立保护性因素,但样本量较小,且仅20例发生肿瘤性死亡,其结果的可靠性不大。而在Kaplan-Meier曲线中,可以观察到LND具有改善OS和RFS的趋势,尤其是在所有患者及≥pT2期患者的RFS方面均差异有统计学意义,≥pT2期患者更为明显。类似的还包括Kondo等[10]的一项前瞻性研究和Ikeda等[11]的一项回顾性研究。Kondo等研究显示模板化LND显著提高了≥pT2期患者的癌症特异性生存率(cancer specific survival,CSS)和OS,LND是降低≥pT2期患者肿瘤死亡风险的独立影响因素。Ikeda等对患者中位随访43个月,≥pT3期患者中,LND组的无病生存率(disease free survival,DFS)和CSS均优于NLND组。此外,我们还将患者按照临床N分期分层后进行比较,结果发现,在cN0期患者中,LND同样具有改善OS和RFS的趋势(图 1e、f),尽管差异无统计学意义,并且其LNM率达16.7%。Dong等[12]认为LND可暴露和切除cN0期患者中隐藏的阳性LN,可以显著改善患者的CSS和OS,建议行LND。对于cN+患者,由于受数据较少限制,我们未进一步验证,但理论上,LND可切除转移灶,达到根治目的,2021版CSCO及2022版CUA指南均明确建议行LND。
早期建议通过切除更多的LN数量来降低肿瘤复发和死亡风险。Zareba等[13]认为较高的LN切除数量与较高的OS相关,每移除5个LN,肿瘤死亡风险降低6.0%。Xylinas等[14]甚至开发了一种LN病理分期预测模型,鼓励外科医生在LND中切除更多数量的LN。然而,Kondo等[15]认为模板化LND的肿瘤学结果更佳。为此,他们通过统计75例LNM患者的原发肿瘤位置及相应的LNM区域,发现肾盂及中上段输尿管肿瘤主要转移至同侧肾门及腔静脉周围(腔静脉旁、腔静脉后)LN(右)、主动脉旁LN(左),下段输尿管肿瘤转移至主动脉分叉以下同侧盆腔LN,LNM率≥30%的区域视为该部位肿瘤需清扫的LN范围,由此形成了“Kondo模式”[16],并在2项前瞻性研究中证实了该模式的合理性[17-18]。本研究证实,我们基于“Kondo模式”行LND,不仅能改善患者的RFS和OS,还能保证LN清扫的数量,多达(12.24±6.43)枚,其中9例患者存在LNM,解剖位置分布见表 3,与Kondo等的结果基本相符。
表 3 UTUC患者LNM位置分布情况原发肿瘤位置 LNM部位 左肾盂(3例) 左RH-LN 6/8、IAC-LN 1/11、
PA-LN 0/2右肾盂(4例) 右RH-LN 7/16、PC-LN 5/12、
PA-LN 1/3左输尿管上段(1例) 左RH-LN 2/2 左输尿管下段(1例) 左II-LN及Ob-LN 1/17,
左EI-LN 0/7注:RH为肾门;PC为腔静脉旁;IAC为腔静脉主动脉间;PA为主动脉旁;II为髂内;EI为髂外;Ob为闭孔。 临床上要推广LND,其手术安全性显得尤为重要。Kondo等[16]对比LND与NLND的术后并发症、术中出血、手术时间、住院时长等参数,发现2组仅在术后并发症方面差异有统计学意义,但均无Ⅲ级及以上并发症。3项小样本前瞻性研究也未发现严重术后并发症,104例LND患者仅1例Ⅲ级并发症,为术后淋巴漏,行术中探查结扎治愈[6, 18-19]。一项meta分析(18 584例)结果显示LND与术后较高的并发症发生率无关,出血、胃肠道、心脏、泌尿系统和淋巴系统并发症在LND中较为常见[20]。本研究收集的29例LND患者的术中出血量、手术时间、住院费用及术后并发症与NLND组比较差异有统计学意义,但2组均无Ⅲ级及以上并发症,LND组的7例Ⅱ级并发症分别为5例术中大出血致术后输血(可能是过度追求大血管区域LND的彻底性,血管损伤较多造成的,但并未延长住院时间,仅引起住院费用的增加)和2例术后淋巴漏行保守治疗,其中1例再入院行禁食肠外营养支持治疗。
机器人具备三维视觉、精准灵活等优点,被广泛用于泌尿外科手术。与LRNU相比,机器人肾输尿管切除术(robotic radical nephroureterectomy,RRNU)能有效避免副损伤,降低术中出血及术后并发症的风险,与更高的LND率及更多的LN清扫数量相关[21-23]。一项meta分析(87 271例)显示,RRNU的术中平均出血量和并发症发生率均最低,分别为163.31 mL和2.0%,而清扫的LN数量最多,高达11枚[24]。Zargar等[25]则前瞻性报道了9.4枚的平均LN清扫数量。在肿瘤学结果方面,RRNU组的5年OS和CSS略高于LRNU组,被认为是RRNU提高了LND率而间接影响了肿瘤学结局[21]。本研究中的5例RRNU由同一名术者完成,切除LN数量略高于LRNU,分别为(12.60±6.41)、(12.17±6.43)枚,但差异无统计学意义(P=0.905)。而RRNU有较高的术中出血量和术后Ⅱ级并发症发生率(均为术中大出血导致的术后输血),分别为(690.00±464.04) mL和40.0%,其原因可能为术者对机器人操作尚不熟练,造成血管损伤。相信借助机器人的优势,经术者进一步磨合后可有效减少这一情况的发生。
本研究初步证实模板化LND的价值和安全性,但同样存在不足。首先,多因素Cox回归分析显示术后挽救性治疗是影响肿瘤结局的独立性因素,但其影响程度可能随治疗方式和疗程的不同而有所差异,而我们在进行2组比较时,未进一步细分,这在一定程度上可能会影响到LND价值的判读。其次,随访时间较短,远期疗效待观察。最后,受单中心小样本回顾性研究的限制,结果可能存在偏倚。
综上所述,UTUC患者LNM高,预后不良,与NLND相比,模板化LND有更高的术中出血量、术后Ⅱ级并发症发生率、住院费用及手术时长,但总体安全,或许机器人手术的发展可改善上述情况,但需进一步的数据支持。另外,除分期优势外,模板化LND还可能具有潜在的治疗价值,尤其是≥pT2期的高分期患者。
利益冲突 所有作者均声明不存在利益冲突
-
表 1 2组患者的临床及随访资料
例,M(Q1,Q3) 项目 LND组(29例) NLND组(45例) χ2/Z P值 性别 0.76 0.383 男 18 22 女 11 23 年龄/岁 64.00(60.00, 67.00) 68.00(62.00, 73.00) 1.40 0.163 ECOG(体力状况评分) — 0.311 0 17 18 1 9 20 2 3 7 侧别 0 1 左 15 22 右 14 23 肿瘤位置 0.10 0.754 肾盂 18 25 输尿管 11 20 危险度分级 0.09 0.758 低危 6 12 高危 23 33 cN分期 <0.001 1 cN0 24 37 cN+ 5 8 术中出血量/mL 150.00(100.00, 200.00) 100.00(50.00, 100.00) -3.36 0.001 手术时间/min 305.00(270.00, 380.00) 235.00(190.00, 286.00) -3.74 < 0.001 术后并发症Clavie分级 — 0.042 0~1 22 42 2 7 3 术后住院时间/d 8.00(7.00, 13.00) 8.00(7.00, 10.00) -1.17 0.242 住院费用/元 35 017.38(31 146.18, 43 445.49) 28 946.73(25 082.60, 36 052.19) -2.97 0.003 病理分级 0 1 低级别 13 19 高级别 16 26 pT分期 0.74 0.388 pTis~pT1 5 13 pT2~pT4 24 32 pN分期 58.89 <0.001 pN0 20 0 pNx 0 39 pN+ 9 6 挽救性治疗 0 1 是 8 12 否 21 33 IVR 0.09 0.758 是 6 12 否 23 33 肿瘤复发 0.63 0.426 是 10 21 否 19 24 肿瘤性死亡 5.41 0.020 是 3 17 否 26 28 随访时间/月 16.00(10.00, 26.00) 24.00(12.00, 42.00) 1.78 0.074 表 2 影响患者术后生存的单因素和多因素Cox回归模型分析结果
因素 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 病理分级 低级别a)/高级别 3.88(1.13~13.29) 0.031 4.97(0.98~25.12) 0.053 肿瘤T分期 pTis~pT1a)/pT2~pT4 2.70(0.63~11.67) 0.183 肿瘤N分期 pN0a)/pNx、pN+ 0.29(0.07~1.26) 0.098 0.63(0.05~7.36) 0.712 LND/NLNDa) 0.35(0.10~1.19) 0.091 0.62(0.07~5.23) 0.66 挽救性治疗 有/无a) 0.27(0.11~0.65) 0.004 0.31(0.11~0.86) 0.024 注:a)表示参照组。 表 3 UTUC患者LNM位置分布情况
原发肿瘤位置 LNM部位 左肾盂(3例) 左RH-LN 6/8、IAC-LN 1/11、
PA-LN 0/2右肾盂(4例) 右RH-LN 7/16、PC-LN 5/12、
PA-LN 1/3左输尿管上段(1例) 左RH-LN 2/2 左输尿管下段(1例) 左II-LN及Ob-LN 1/17,
左EI-LN 0/7注:RH为肾门;PC为腔静脉旁;IAC为腔静脉主动脉间;PA为主动脉旁;II为髂内;EI为髂外;Ob为闭孔。 -
[1] 中国医师协会泌尿外科医师分会肿瘤专业委员会, 中国医师协会泌尿外科医师分会上尿路尿路上皮癌(CUDA-UTUC)协作组. 上尿路尿路上皮癌诊断与治疗中国专家共识[J]. 中华泌尿外科杂志, 2018, 39(7): 485-488. doi: 10.3760/cma.j.issn.1000-6702.2018.07.002
[2] Moschini M, Foerster B, Abufaraj M, et al. Trends of lymphadenectomy in upper tract urothelial carcinoma(UTUC)patients treated with radical nephroureterectomy[J]. World J Urol, 2017, 35(10): 1541-1547. doi: 10.1007/s00345-017-2026-4
[3] 白航, 单祖卷, 余闫宏, 等. 上尿路尿路上皮癌腹腔镜下基于模板的淋巴结清扫术的价值初探(附52例报道)[J]. 现代泌尿生殖肿瘤杂志, 2022, 14(4): 213-218.
[4] Kondo T, Takagi T, Tanabe K. Therapeutic role of template-based lymphadenectomy in urothelial carcinoma of the upper urinary tract[J]. World J Clin Oncol, 2015, 6(6): 237-251. doi: 10.5306/wjco.v6.i6.237
[5] Nazzani S, Mazzone E, Preisser F, et al. Rates of lymph node invasion and their impact on cancer specific mortality in upper urinary tract urothelial carcinoma[J]. Eur J Surg Oncol, 2019, 45(7): 1238-1245. doi: 10.1016/j.ejso.2018.12.004
[6] Huang JW, Qian HY, Yuan YC, et al. Prospective clinical trial of the oncologic outcomes and safety of extraperitoneal laparoscopic extended retroperitoneal lymph node dissection at time of nephroureterectomy for upper tract urothelial carcinoma[J]. Front Oncol, 2022, 12: 791140. doi: 10.3389/fonc.2022.791140
[7] Lughezzani G, Jeldres C, Isbarn H, et al. Nephroureterectomy and segmental ureterectomy in the treatment of invasive upper tract urothelial carcinoma: a population-based study of 2299 patients[J]. Eur J Cancer, 2009, 45(18): 3291-3297. doi: 10.1016/j.ejca.2009.06.016
[8] Choo MS, Yoo S, Yuk HD, et al. Survival benefits based on the number of lymph nodes removed during radical nephroureterectomy for upper tract urothelial carcinoma: systematic review and meta-analysis[J]. J Clin Med, 2020, 9(6): 1933. doi: 10.3390/jcm9061933
[9] Pallauf M, D'Andrea D, Knig F, et al. Diagnostic accuracy of clinical lymph node staging for upper tract urothelial cancer patients: a multicenter, retrospective, observational study[J]. J Urol, 2023, 209(3): 515-524. doi: 10.1097/JU.0000000000003085
[10] Kondo T, Hara I, Takagi T, et al. Template-based lymphadenectomy in urothelial carcinoma of the renal pelvis: a prospective study[J]. Int J Urol, 2014, 21(5): 453-459. doi: 10.1111/iju.12338
[11] Ikeda M, Matsumoto K, Sakaguchi K, et al. Effect of lymphadenectomy during radical nephroureterectomy in locally advanced upper tract urothelial carcinoma[J]. Clin Genitourin Cancer, 2017, 15(5): 556-562. doi: 10.1016/j.clgc.2017.04.004
[12] Dong F, Xu TY, Wang XJ, et al. Lymph node dissection could bring survival benefits to patients diagnosed with clinically node-negative upper urinary tract urothelial cancer: a population-based, propensity score-matched study[J]. Int J Clin Oncol, 2019, 24(3): 296-305. doi: 10.1007/s10147-018-1356-6
[13] Zareba P, Rosenzweig B, Winer AG, et al. Association between lymph node yield and survival among patients undergoing radical nephroureterectomy for urothelial carcinoma of the upper tract[J]. Cancer, 2017, 123(10): 1741-1750. doi: 10.1002/cncr.30516
[14] Xylinas E, Kluth L, Rieken M, et al. External validation of the pathological nodal staging score in upper tract urothelial carcinoma: a population-based study[J]. Urol Oncol, 2017, 35(1): 33. e21-33. e26.
[15] Kondo T, Hashimoto Y, Kobayashi H, et al. Template-based lymphadenectomy in urothelial carcinoma of the upper urinary tract: impact on patient survival[J]. Int J Urol, 2010, 17(10): 848-854. doi: 10.1111/j.1442-2042.2010.02610.x
[16] Kondo T, Tanabe K. Role of lymphadenectomy in the management of urothelial carcinoma of the bladder and the upper urinary tract[J]. Int J Urol, 2012, 19(8): 710-721. doi: 10.1111/j.1442-2042.2012.03009.x
[17] Kondo T, Hara I, Takagi T, et al. Template-based lymphadenectomy reduces the risk of regional lymph node recurrence among patients with upper/middle ureteral cancer [J]. Int J Clin Oncol, 2017, 22(1): 145-152. doi: 10.1007/s10147-016-1024-7
[18] Abe T, Takada N, Matsumoto R, et al. Outcome of regional lymphadenectomy in accordance with primary tumor location on laparoscopic nephroureterectomy for urothelial carcinoma of the upper urinary tract: a prospective study[J]. J Endourol, 2015, 29(3): 304-309. doi: 10.1089/end.2014.0369
[19] Rao SR, Correa JJ, Sexton WJ, et al. Prospective clinical trial of the feasibility and safety of modified retroperitoneal lymph node dissection at time of nephroureterectomy for upper tract urothelial carcinoma[J]. BJU Int, 2012, 110(11 Pt B): E475-E480. doi: 10.1111/j.1464-410X.2012.11170.x
[20] Chan VW, Wong CHM, Yuan YH, et al. Lymph node dissection for upper tract urothelial carcinoma: a systematic review[J]. Arab J Urol, 2020, 19(1): 37-45.
[21] Li CC, Chang CH, Huang CP, et al. Comparing oncological outcomes and surgical complications of hand-assisted, laparoscopic and robotic nephroureterectomy for upper tract urothelial carcinoma[J]. Front Oncol, 2021, 11: 731460. doi: 10.3389/fonc.2021.731460
[22] Kenigsberg AP, Smith W, Meng XS, et al. Robotic nephroureterectomy vs laparoscopic nephroureterectomy: increased utilization, rates of lymphadenectomy, decreased morbidity robotically[J]. J Endourol, 2021, 35(3): 312-318. doi: 10.1089/end.2020.0496
[23] Veccia A, Carbonara U, Djaladat H, et al. Robotic vs laparoscopic nephroureterectomy for upper tract urothelial carcinoma: a multicenter propensity-score matched pair tetrafecta analysis(ROBUUST collaborative group)[J]. J Endourol, 2022, 36(6): 752-759. doi: 10.1089/end.2021.0587
[24] Veccia A, Antonelli A, Francavilla S, et al. Robotic versus other nephroureterectomy techniques: a systematic review and meta-analysis of over 87, 000 cases[J]. World J Urol, 2020, 38(4): 845-852. doi: 10.1007/s00345-019-03020-1
[25] Zargar H, Krishnan J, Autorino R, et al. Robotic nephroureterectomy: a simplified approach requiring no patient repositioning or robot redocking[J]. Eur Urol, 2014, 66(4): 769-777. doi: 10.1016/j.eururo.2014.02.060
期刊类型引用(2)
1. 冯坤,宋丁铭,陈华进,李航旭,朱佳宝,金艳阳. UTUC腹腔镜下根治性切除术联合LND的回顾性分析. 锦州医科大学学报. 2024(04): 66-71 .  百度学术
百度学术
2. 刘智艳,任靖文,安云昭,徐彬,罗光恒. 上尿路尿路上皮癌中肾输尿管根治性切除术联合淋巴结清扫的研究进展. 临床泌尿外科杂志. 2024(11): 1014-1018 .  本站查看
本站查看
其他类型引用(0)
-




 DownLoad:
DownLoad: