Clinical characteristics analysis and treatment strategies of neuroendocrine prostate cancer under MDT mode
-
摘要: 神经内分泌前列腺癌是前列腺癌的特殊类型,具有独特的临床及病理特征,本文报道3例典型病例。例1,63岁,初始前列腺特异性抗原(prostate specific antigen,PSA)34.39 ng/mL,病理确诊前列腺腺癌,Gleason评分9分(4+5),伴少数区域神经内分泌分化,68Ga-PSMA PET/CT分期T3bN0M1b,3年内分泌治疗后出现双下肢水肿,右肺动脉干及肾下极平面下腔静脉栓子,遂行转移淋巴结二次穿刺,获取病理为前列腺小细胞癌。MDT讨论后更换恩杂鲁胺,同时行EP方案化疗。例2,53岁,初始PSA 34.13 ng/mL,穿刺病理前列腺腺癌,Gleason评分8分(3+5),临床分期T4N1M1b。免疫组织化学证实神经内分泌阳性,在内分泌治疗基础上行腹主动脉旁及盆腔挽救性放疗。例3,40岁,初始PSA 47.99 ng/mL,穿刺活检为前列腺腺癌,Gleason评分8分(4+4),临床分期T4N1M1a。行去势+抗雄+新辅助化疗6个周期,机器人辅助腹腔镜下前列腺减瘤性切除术+扩大盆腔淋巴结清扫,病理提示前列腺腺癌伴高级别神经内分泌癌,MDT讨论后行盆腔延伸野及前列腺瘤床区、盆腹腔可见肿大淋巴结挽救性放疗。神经内分泌前列腺癌发病相对年轻,PSA水平与肿瘤分期不相称,原发病灶重复穿刺或转移灶获取病理具有重要诊断价值,MDT模式可以有力保证规范化治疗。Abstract: Neuroendocrine prostate cancer is a special type of prostate cancer with unique clinical and pathological features, and three typical cases were reported here. Case 1, 63 years old, initial PSA 34.39 ng/mL, pathologically confirmed prostate adenocarcinoma, Gleason score 9(4+5), with a few regional neuroendocrine differentiation, 68Ga-PSMA PET/CT stage T3bN0M1b, 3 years of endocrine therapy, double lower limbs edema, right pulmonary artery trunk and inferior vena cava embolus of lower renal pole, secondary puncture of metastatic lymph nodes, obtain pathology as prostate small cell carcinoma. Enzalutamide and chemotherapy with EP protocol were replaced after MDT. Case 2, 53 years old, initial PSA 34.13 ng/mL, puncture pathological adenocarcinoma of prostate, Gleason score 8(3+5), and clinical stage T4N1M1b. Immunohistochemistry confirmed positive neuroendocrine staining, and para-aortic and pelvic salvage radiotherapy were performed based on endocrine therapy. Case 3, 40 years old, initial PSA 47.99 ng/mL, needle biopsy was prostate adenocarcinoma with Gleason score 8(4+4) and clinical stage T4N1M1a. Six cycles of castration+antiandrogen+neoadjuvant chemotherapy, robot-assisted laparoscopic prostate tumor resection+expand pelvic lymph nodes dissection were performed. Pathological results showed prostate adenocarcinoma with high-grade neuroendocrine cancer. The pelvic extension field and the forefront adenoma bed area, pelvic cavity visible enlarged lymph nodes salvage radiotherapy were performed after MDT. The onset of neuroendocrine prostate cancer is relatively young, and PSA level is not commensurate with the tumor stage. Repeated puncture of the primary lesion or obtaining pathology of the metastatic lesion has important diagnostic value, and MDT mode can effectively guarantee standardized treatment.
-
对于晚期前列腺癌患者,去势治疗控制病情的中位时间为18~24个月,之后几乎所有患者最终进展成为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[1]。根据分子机制不同,CRPC可以分为两大类,雄激素信号轴依赖型和非雄激素信号轴依赖型。在临床中,雄激素信号通路依赖型患者为CRPC的主要类型,占90%~95%,这类患者前列腺特异性抗原(prostate specific antigen,PSA)水平通常较高。非雄激素信号轴依赖型CRPC包括神经内分泌前列腺癌(neuroendocrine prostate cancer,NEPC),是相对少见的前列腺癌亚型,其对内分泌治疗不敏感,具有高度侵袭性[2-3]。现报告我院2017年9月—2021年4月收治的3例NEPC病例,并结合文献回顾,将NEPC的临床特点、病理特征及诊治方案进行总结归纳,为临床治疗提供参考。
1. 病例资料
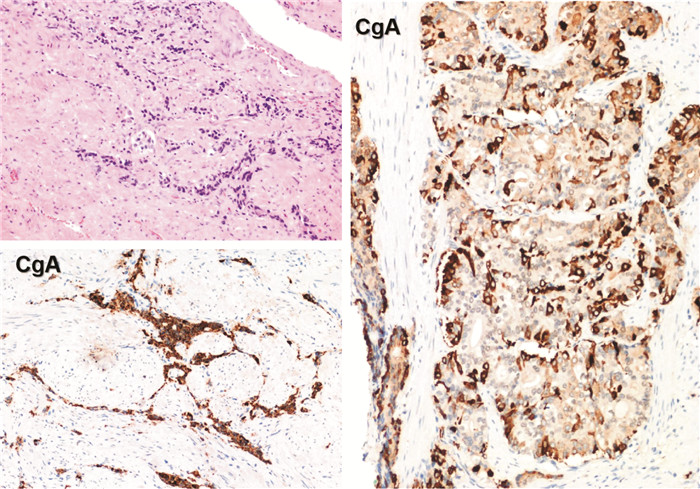
例1,63岁,2018年9月体检时发现PSA 34.39 ng/mL,多参数磁共振提示前列腺左侧外周带、尖部及中央带左后部前列腺癌,侵犯左侧精囊,伴骨盆、双侧髋臼、左侧股骨颈多发转移瘤(T3bN0M1b)。随后行前列腺穿刺活检,病理:前列腺腺癌,Gleason评分9分(4+5),ISUP分级5组,伴少数区域神经内分泌分化。PSMA PET/CT提示前列腺左侧外周带,中央带左后部团块状等密度病变,部分与左侧精囊分界不清,呈不均匀68Ga-PSMA摄取增高,多考虑为恶性病变,前列腺癌伴左侧精囊侵犯可能性大;盆腔、腹腔及腹膜后未见明显肿大淋巴结;左侧第4、5、6肋骨及胸3棘突、骨盆多处、左侧股骨颈可见多发骨化性病变,呈不同程度68Ga-PSMA摄取增高,多考虑为转移性病变。先给予去势+抗雄治疗(戈舍瑞林+比卡鲁胺),同时使用唑来膦酸进行骨保护治疗。3个月后复查PSA降至3.73 ng/mL,睾酮23.5 ng/dL。2019年5月曾行多西他赛化疗1次,患者因出现过敏反应无法耐受。PSA水平维持在0.39~1.15 ng/mL之间。2021年6月出现双下肢水肿,行血管彩超提示左侧髂总静脉癌栓,双侧髂血管旁肿大淋巴结,左侧较大一约6.1 cm×3.9 cm。盆腔MRI:盆腔、双侧腹股沟淋巴结及盆骨多发转移瘤,伴部分病变周围软组织水肿性改变。泌尿外科在工作微信群提出MDT并上传资料,放射科专家对比阅片后考虑肿瘤负荷与PSA不相称,病理科专家建议对转移淋巴结二次穿刺,并再次获取病理:(左颈部、右侧髂血管旁)淋巴结穿刺活检,形态结合免疫组织化学支持小细胞癌。免疫组织化学:CD56(+),Syn(+),INSM1(+),TTF-1(+),CK8/18(+);P504S少数(+);CgA极少数(+);NKX3.1少数(弱+);ERG(-)、P63(-)、CK7(-)、CK20(-)、NapsinA(-)、TG(-);Ki-67(+,>90%)(图 1)。更换新型内分泌药物恩杂鲁胺,同时维持去势治疗。对转移病灶组织及外周血进行基因检测:ERG、TMPRSS2基因重排,突变丰度29.26%~30.63%。2021年7月出现肉眼血尿,行CT检查:左侧锁骨上窝淋巴结转移,左侧腰大肌、髂腰肌转移瘤包绕左侧输尿管,继发左肾积水,右肺动脉干及肾下极平面下腔静脉栓子。监测PSA 0.1 ng/mL,睾酮13.84 ng/dL。肿瘤内科专家建议铂类化疗方案,2021年8月绿色通道转诊至肿瘤科行EP方案化疗1周期,患者血液学毒性明显,无法耐受。2021年10月因呼吸衰竭死亡。
例2,53岁,2017年6月因尿频、尿急、肉眼血尿于我院就诊,初始PSA 34.13 ng/mL。前列腺磁共振平扫+弥散加权:前列腺癌突破包膜,侵犯双侧神经血管束、精囊、膀胱后壁,直肠前脂肪间隙部分变窄、消失,盆腔内及右侧髂血管旁可见多发肿大淋巴结影,较大淋巴结大小约2.1 cm×2.3 cm,并下腰椎、左侧髂骨、骶骨左侧多发骨转移(T4N1M1)。骨扫描提示T10椎体、骶骨骨代谢活跃,多考虑肿瘤骨转移。遂行68Ga-PSMA PET/CT检查发现前列腺尖部、左后、右后、右前外周带及中央带左前部结节样显像剂高度异常摄取,考虑前列腺癌;前列腺增生。左颈部(Ⅵ区)血管旁、腹主动脉旁、右腹股沟、右髂血管旁多发肿大淋巴结伴显像剂异常摄取,考虑淋巴结转移。T10椎体椎板、L5椎体、S2椎体、左髂骨局限性显像剂异常摄取,考虑肿瘤骨转移。于我院行经直肠前列腺穿刺活检,病理诊断:前列腺癌,Gleason评分8分(3+5)。先行CAB内分泌治疗(戈舍瑞林+比卡鲁胺),同时予以多西他赛化疗,唑来膦酸骨保护治疗。2个月后PSA降至0.155 ng/mL,睾酮降至34.9 ng/dL。2次化疗后,患者转氨酶均有明显升高,因在治疗过程中出现不良反应,遂行MDT讨论,肿瘤内科建议停止化疗(肝功异常与化疗相关),病理科建议进一步明确神经内分泌分化或小细胞癌,放疗科建议可联合挽救性放疗。免疫组织化学CgA(+),Syn(+),病理证实神经内分泌阳性(图 2)。给予腹主动脉旁(40 Gy)及盆腔(45 Gy)外放射治疗。半年后复查68Ga-PSMA PET/CT,发现腹腔及盆腔淋巴结缩小,核素摄取减弱,PSA降至0.015 ng/mL。
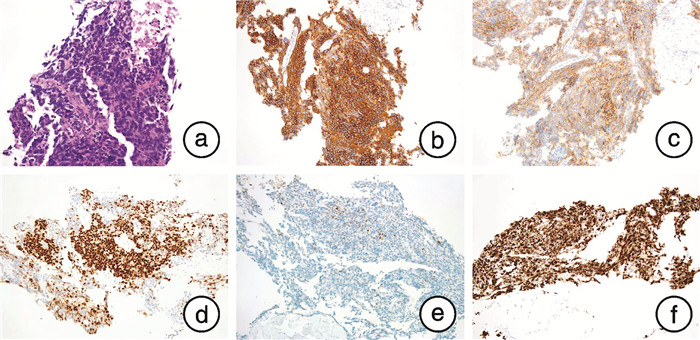
例3,40岁,2018年3月因“排尿困难,下腹部憋胀2周”入院。直肠指诊:前列腺双侧质地较硬,可触及结节。初始PSA 47.99 ng/mL。前列腺磁共振平扫+弥散加权:前列腺异常改变,考虑前列腺癌并膀胱后壁受累,双侧髂血管旁多发肿大淋巴结,考虑淋巴结转移。初次68Ga-PSMA PET/CT:前列腺双侧外周带、右侧尖部多个结节病变,L2~L5椎体水平腹主动脉走行区、腹主动脉分叉区、双侧髂动脉走形区多个淋巴结核素异常摄取,考虑转移。经直肠前列腺穿刺活检:双侧均为前列腺腺癌,Gleason评分9分(4+5),广泛神经侵犯,个别区域存在神经内分泌细胞位于普通型前列腺腺癌内。遂行戈舍瑞林+比卡鲁胺治疗,并联合多西他赛化疗6个周期。4个月后第2次68Ga-PSMA PET/CT评估:前列腺缩小,PSMA摄取减低,治疗有效。L2~L5椎体水平腹主动脉走行区、腹主动脉分叉区、双侧髂动脉走形区多个淋巴结缩小,摄取明显减低,治疗有效。2018年9月行机器人辅助腹腔镜下减瘤性前列腺切除术+扩大盆腔淋巴结清扫,病理:(前列腺内分泌治疗和化疗后)前列腺腺癌伴高级别神经内分泌癌及神经内分泌细胞位于普通型前列腺腺癌内,可见脉管及神经侵犯,肿瘤总量约占送检前列腺的40%。右外周查见局灶前列腺外侵犯;(膀胱颈口)查见癌组织;左侧基底切缘及左侧外周切缘查见癌组织,其余切缘、双侧精囊及双侧输精管未查见癌组织。(左侧盆腔)淋巴结(3/9)、(右侧盆腔)淋巴结(5/9)查见转移癌,内分泌反应治疗后评估:部分反应(图 3)。术后继续内分泌治疗,血PSA降至0.09 ng/mL。2019年4月PSA逐渐升高至1.86 ng/mL,行第3次68Ga-PSMA PET/CT:L3~L4椎体水平腹主动脉周围、腰5椎体前方多个新发淋巴结,核素摄取升高,多考虑新发转移。在治疗过程中,患者疾病出现进展,泌尿外科提出MDT讨论,后转诊至放疗科行盆腔延伸野及前列腺瘤床区、盆腹腔可见肿大淋巴结挽救性放疗。2020年1月复查PSA 5.11 ng/mL,进展为CRPC,行第4次68Ga-PSMA PET/CT:前列腺缺如,前列腺床区未见占位,原L3~L4椎体水平腹主动脉周围、腰5椎体前方多个淋巴结基本消失,左侧锁骨后方甲状腺左叶外侧几枚新发淋巴结,异常摄取核素升高,多考虑新发转移。行基因检测未检测到致病突变。经过再次MDT讨论更换治疗方案为曲普瑞林+阿比特龙+多西他赛+卡铂化疗,颈部新发淋巴结转移灶行局部放疗。血PSA降至9.04 ng/mL,睾酮2.5 ng/dL。颈部CT:左颈根部肿大淋巴结较前缩小,病情稳定。
2. 讨论
MDT已成为复杂肿瘤诊治的必由之路,通常由至少2个以上不同学科专家组成工作组,针对某一疾病,在固定时间、地点通过会议形式,提出适合患者的最佳治疗方案,继而由相关科室单独或联合执行。我院前列腺癌MDT团队于2013年由放射科、核医学科、病理科、肿瘤内科、放疗科、泌尿外科共同建立,泌尿外科1名专家担任团队秘书,定期组织开展新进展学习、联合查房、疑难病例讨论、患教活动及学术会议,建立工作微信群,2名专职随访护士管理,研究生负责收集患者资料,建立疑难病例档案。NEPC临床发展演变复杂,缺乏有效的诊疗方案。本组患者首诊均在泌尿外科,由泌尿外科专家通过工作微信群提出MDT,由1名专职随访护士收集资料,在疾病初始、进展阶段或出现不良反应需更改诊疗方案时进行线上或线下讨论,执行治疗科室间绿色通道转诊,并定期通报患者病情,及时总结经验。
NEPC按治疗相关或发生时序可分为原发型NEPC和治疗相关的神经内分泌前列腺癌(treatment-related neuroendocrine prostate cancer,t-NEPC)[4]。原发型NEPC罕见(< 1%),多数患者在诊断后1~2年内死亡,疾病进展速度快[5]。随着近些年新型内分泌药物的普及,内分泌治疗后诱导的NEPC发病率明显上升,在CRPC阶段约占17%,这类患者肿瘤组织形态/分子表型多变,是临床诊断治疗的难点[6-8]。t-NEPC诊断基本标准:前列腺癌伴有神经内分泌(NE)分化,单纯性或混合性(通常为高级别腺癌);免疫组织化学染色证实(Syn和CgA);去势治疗病史。文献报道进展为t-NEPC患者的中位生存时间为7个月,单纯性小细胞神经内分泌癌(small cell neuroendocrine carcinoma,SCNEC)总生存时间远低于混合型SCNEC(8.9个月vs 26.1个月)[9]。本组病例1通过转移灶活检确诊为小细胞NEPC后4个月即病情进展死亡。
2022年第5版WHO将NEPC病理分为:①t-NEPC;②分化好的神经内分泌肿瘤;③SCNEC;④大细胞神经内分泌癌(large cell neuroendocrine carcinoma, LCNEC);⑤混合型神经内分泌肿瘤[10]。此版病理强调神经内分泌肿瘤的病理形态学特征。高级别腺癌建议使用神经内分泌分化的免疫组织化学检测(如CgA、Syn、CD56、INSM1),检出NE标记物阳性细胞的比率较高,但局灶性NE标记物阳性细胞是否具有预后意义存在争议,需谨慎评价[11]。具有双相特征的前列腺癌患者PSA升高,对去势治疗的反应也可能表明这些肿瘤代表了一种高级别腺癌的变异体,这进一步强调了准确分类的重要性,并将具有双相特征的前列腺癌与目前公认的高级别神经内分泌癌区分开来[12]。对于分化差、核分裂活跃的癌进行检查时,使用免疫组织化学可能有助于增加对具有双相表型的前列腺癌的识别和进一步定性。NEPC分子特征目前认为包括:AR信号弱或缺失;RB1缺失(70%~90%);TP53缺失(56%~67%);MYCN过表达(约40%);ERG重排(EST相关基因重排)(约50%);BRN2、SOX2和(或)PEG10上调;REST下调[13]。本组病例1存在TMPRSS2-ERG基因重排,特异性强,提示患者预后较差。并且有研究表明,该类突变的患者使用多西他赛相比于无突变的患者有较差的PSA反应率[14]。
NEPC临床表现具有一定特点:患者发病年龄较轻,PSA往往呈现出与肿瘤负荷不相称的较低水平,且肿瘤进展迅速,淋巴结转移发生早,多数患者存在内脏或溶骨性转移。部分患者可表现为副瘤综合征如高钙血症、皮质醇增多、重症肌无力等[15]。与普通前列腺癌好发骨化性骨转移不同,NEPC骨转移灶多为溶骨性改变。如果影像学提示肿瘤进展显著,但PSA不高或升高不明显,血清NSE升高对NEPC具有重要提示意义。对于CRPC患者,重复前列腺穿刺或转移灶穿刺活检可以有效帮助诊断NEPC,指导治疗方案。本组病例发病年龄都相对年轻,初诊时肿瘤负荷重,转移病灶多,PSA不高,确诊均以前列腺或转移灶二次活检组织形态学结合免疫组织化学判断。
以铂类为基础的化疗(依托泊苷/多西他赛+铂类)是首选治疗方案,但有效持续时间较短,很快出现耐药及疾病进展[16]。一项纳入14例经组织学诊断为NEPC的研究表明,一线铂类药物治疗的客观缓解率为66.7%,中位无进展生存时间为7.5个月,中位总生存时间为20.3个月[17]。另一项纳入43例NEPC的研究表明,其中30%(13/43)存在DRG基因缺失,其中11例(11/13,85%)患者对铂类化疗出现有效反应,包括7例BRCA1/2突变和2例MSH2突变[18]。放射治疗可控制转移性NEPC的局部症状,常与化疗联用,但其有效性仍存争议。理想状态下,挽救性放疗应在PSA达到0.4 ng/mL前开始,而不需等待影像学检查发现局部复发病灶。一项荟萃研究表明,挽救性放疗前PSA值每升高0.1 ng/mL,挽救性放疗后无进展生存率降低2.4%[19]。对于放射技术的选择,三维适形放疗、调强放疗、立体定向放疗可以提高精准度、降低损伤。本组病例2和3采用挽救性放疗,改善了患者无进展生存期,提高了长期生存率。NEPC的治疗复杂,需综合各学科专家的诊疗意见,在临床实践中以指南及循证医学证据为指导,结合患者的具体情况(包含患者意愿),确定个体化诊疗方案。本组患者分别在治疗初始及疾病进展时进行MDT讨论,充分考虑患者意愿后给出诊疗建议,取得较为满意的效果。
综上所述,NEPC的诊断需依靠病理组织学特征及免疫组织化学表型,临床表现具有一定特点,对原发病灶重复穿刺或通过转移灶获取病理具有重要诊断价值,转移灶的挽救性放疗对于控制症状及改善无进展生存期具有价值,MDT模式可以有力保证规范化治疗。
利益冲突 所有作者均声明不存在利益冲突
-
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. doi: 10.3322/caac.21551
[2] Zaffuto E, Pompe R, Zanaty M, et al. Contemporary incidence and cancer control outcomes of primary neuroendocrine prostate cancer: a SEER database analysis[J]. Clin Genitourin Cancer, 2017, 15(5): e793-e800. doi: 10.1016/j.clgc.2017.04.006
[3] Aggarwal R, Huang JT, Alumkal JJ, et al. Clinical and genomic characterization of treatment-emergent small-cell neuroendocrine prostate cancer: a multi-institutional prospective study[J]. J Clin Oncol, 2018, 36(24): 2492-2503. doi: 10.1200/JCO.2017.77.6880
[4] Abida W, Cyrta J, Heller G, et al. Genomic correlates of clinical outcome in advanced prostate cancer[J]. Proc Natl Acad Sci U S A, 2019, 116(23): 11428-11436. doi: 10.1073/pnas.1902651116
[5] Cornford P, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG guidelines on prostate cancer. part Ⅱ: treatment of relapsing, metastatic, and castration-resistant prostate cancer[J]. Eur Urol, 2017, 71(4): 630-642. doi: 10.1016/j.eururo.2016.08.002
[6] Weissenrieder JS, Reilly JE, Neighbors JD, et al. Inhibiting geranylgeranyl diphosphate synthesis reduces nuclear androgen receptor signaling and neuroendocrine differentiation in prostate cancer cell models[J]. Prostate, 2019, 79(1): 21-30. doi: 10.1002/pros.23707
[7] Chen RQ, Dong XS, Gleave M. Molecular model for neuroendocrine prostate cancer progression[J]. BJU Int, 2018, 122(4): 560-570. doi: 10.1111/bju.14207
[8] Mu P, Zhang ZD, Benelli M, et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53-and RB1-deficient prostate cancer[J]. Science, 2017, 355(6320): 84-88. doi: 10.1126/science.aah4307
[9] Deorah S, Rao MB, Raman R, et al. Survival of patients with small cell carcinoma of the prostate during 1973-2003: a population-based study[J]. BJU Int, 2012, 109(6): 824-830. doi: 10.1111/j.1464-410X.2011.10523.x
[10] Netto GJ, Amin MB, Berney DM, et al. The 2022 World Health Organization Classification of Tumors of the Urinary System and Male Genital Organs-Part B: Prostate and Urinary Tract Tumors[J]. Eur Urol, 2022, 82(5): 469-482. doi: 10.1016/j.eururo.2022.07.002
[11] Mottet N, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG guidelines on prostate cancer. part 1: screening, diagnosis, and local treatment with curative intent[J]. Eur Urol, 2017, 71(4): 618-629. doi: 10.1016/j.eururo.2016.08.003
[12] Prendeville S, Al-Bozom I, Compérat E, et al. Prostate carcinoma with amphicrine features: further refining the spectrum of neuroendocrine differentiation in tumours of primary prostatic origin?[J]. Histopathology, 2017, 71(6): 926-933. doi: 10.1111/his.13330
[13] 古亚楠, 惠珂, 吴开杰. 药物诱导性神经内分泌前列腺癌研究的最新进展[J]. 现代泌尿外科杂志, 2020, 25(2): 190-193. doi: 10.3969/j.issn.1009-8291.2020.02.023
[14] Davies AH, Beltran H, Zoubeidi A. Cellular plasticity and the neuroendocrine phenotype in prostate cancer[J]. Nat Rev Urol, 2018, 15(5): 271-286. doi: 10.1038/nrurol.2018.22
[15] Reisch N, Reincke M. Endocrine paraneoplastic syndromes[J]. Internist, 2018, 59(2): 125-133. doi: 10.1007/s00108-017-0377-y
[16] Corn PG, Heath EI, Zurita A, et al. Cabazitaxel plus carboplatin for the treatment of men with metastatic castration-resistant prostate cancers: a randomised, open-label, phase 1-2 trial[J]. Lancet Oncol, 2019, 20(10): 1432-1443. doi: 10.1016/S1470-2045(19)30408-5
[17] Iwamoto H, Nakagawa R, Makino T, et al. Treatment outcomes in neuroendocrine prostate cancer[J]. Anticancer Res, 2022, 42(4): 2167-2176. doi: 10.21873/anticanres.15699
[18] Zhu SM, Zhang Z, Zhang H, et al. DNA-repair status should be assessed in treatment-emergent neuroendocrine prostate cancer before platinum-based therapy[J]. Prostate, 2022, 82(4): 464-474. doi: 10.1002/pros.24292
[19] van den Broeck T, van den Bergh RCN, Arfi N, et al. Prognostic value of biochemical recurrence following treatment with curative intent for prostate cancer: a systematic review[J]. Eur Urol, 2019, 75(6): 967-987. doi: 10.1016/j.eururo.2018.10.011
期刊类型引用(1)
1. 王玮. 调强放疗联合内分泌治疗前列腺癌的临床研究. 中国男科学杂志. 2025(01): 76-80 .  百度学术
百度学术
其他类型引用(0)
-




 下载:
下载: