Application of holographic image CT three dimensional reconstruction in robotic assisted laparoscopic nephron-sparing surgery
-
摘要: 目的 探讨全息影像CT三维重建技术通过选择性肾动脉分支阻断在肾部分切除术中对肾功能的保护作用。方法 回顾性分析2020年1月—2021年12月因肾脏肿瘤在陆军军医大学第一附属医院泌尿外科接受机器人辅助腹腔镜肾部分切除术并行全息影像CT三维重建的患者的临床资料。共纳入患者62例,男29例,女33例,平均年龄(53.1±11.5)岁,平均体重指数(24.1±3.3) kg/m2。根据重建结果术前制定手术方案,分为肾动脉主干阻断组(33例)和选择性分支阻断组(29例)两组。术前评估两组患者年龄、性别、体重指数、肿瘤平均直径、R.E.N.A.L.评分等一般情况,记录分析术中手术时间、热缺血时间、出血量、术后住院时间、中转主干阻断、并发症,对比分析术前及术后3 d肾功能显像(ECT)测的患肾肾小球滤过率(GFR)差值和术前及术后1个月血肌酐差值、抽血估算GFR差值等结果。结果 62例手术均成功完整切除肾脏肿瘤,切缘均为阴性,无患者中转开放或改行根治性切除术,均未发生大出血、尿瘘、感染、周围脏器损伤等并发症。两组患者在一般资料和术中出血量、手术时间、热缺血时间、术后住院时间等指标上无明显差异。选择性分支阻断组在术前及术后3 d患肾GFR差值、术前及术后1个月血肌酐差值、术前及术后1个月抽血估算GFR差值均明显小于主干阻断组(P< 0.05)。结论 全息影像CT三维重建可清晰立体地显示肾脏肿瘤、血管和周围结构的关系,有助于术中行选择性肾动脉分支阻断的肾部分切除术,选择性的肾动脉分支阻断可更好地保护肾脏功能。
-
关键词:
- 全息影像CT三维重建 /
- 肾动脉选择性分支阻断 /
- 肾部分切除术
Abstract: Objective To explore the protective effect of holographic image CT three dimensional reconstruction on renal function by selective renal artery branch occlusion in partial nephrectomy.Methods The clinical data of 62 patients who underwent robotic assisted laparoscopic partial nephrectomy with holographic image CT three dimensional reconstruction for renal tumors in Department of Urology, First Affiliated Hospital of Army Medical University from January 2020 to December 2021 were collected retrospectively. There were 33 females and 29 males whose mean age was (53.1±11.5) years old and mean body mass index was (24.1±3.3) kg/m2. According to the reconstruction results, surgical plan was formulated before surgery, and patiens were divided into the main renal artery occlusion group (n=33) and the selective renal artery branch occlusion group (n=29). Preoperative evaluation of age, sex, body mass index, mean tumor diameter, R.E.N.A.L. score and intraoperative operation time, warm ischemia time, blood loss, transferring to main renal artery occlusion, complications and postoperative length of hospital stay were recorded and analyzed. Glomerular filtration rate (GFR) change by Emission Computed Tomography (ECT) of involved kidney before and 3 days after surgery, creatinine change and estimated GFR by blood drawing before and 1 month after surgery were compared between two groups.Results All of the 62 patients were completed the operation successfully with negative surgical margins and no patient was converted to open surgery or radical resection. No massive bleeding, urinary fistula, infection or injury of surrounding organs occurred. There were no significant differences in general data, intraoperative blood loss, operation time, warm ischemia time, postoperative hospital stay or other indicators between the two groups. The change of GFR by ECT before and 3 days after operation, creatinine change and estimated GFR by blood drawing before and 1 month after operation in the selective renal artery branch occlusion group were significantly lower than those in the main renal artery occlusion group (P< 0.05).Conclusion Holographic image CT three dimensional reconstruction technique can clearly and accurately display the renal tumor structure, blood vessel and the relation with surrounding tissues, helping surgeons to make better choice for performing the surgery with the selective renal artery branch occlusion partial nephrectomy so as to better protect the renal function. -
保留肾单位的肾部分切除术是治疗局限性肾脏肿瘤的金标准[1]。手术切除肿瘤的过程需要临时阻断肾动脉以获得良好的视野以便完成切除和缝合,肿瘤大小、切除的范围、缝合深度、热缺血时间等都是术后患肾功能的重要影响因素,如何在保证肿瘤完整切除的基础上尽可能少影响患侧肾脏功能是肾部分切除术的难点。随着CT影像技术和计算机图形技术的进步,全息影像三维重建技术越来越多应用到临床,尤其是外科手术中[2-4]。本研究旨在探讨全息影像CT三维重建技术对肾部分切除术患者肾功能的保护作用。
1. 资料与方法
1.1 临床资料
回顾性分析2020年1月—2021年12月因肾肿瘤在陆军军医大学第一附属医院泌尿外科接受肾部分切除术并行全息影像CT三维重建的患者的临床资料。共纳入患者62例,其中男29例,女33例,平均年龄(53.1±11.5)岁,平均体重指数(24.1±3.3) kg/m2。根据三维重建结果,术前讨论制定术中肾动脉阻断方案,分为主干阻断组(33例)和选择性分支阻断组(29例),两组患者在年龄、性别、体重指数、肿瘤平均直径、肿瘤R.E.N.A.L.评分等一般资料上比较差异均无统计学意义(表 1)。本研究为回顾性研究,于2021年9月经陆军军医大学第一附属医院伦理委员会批准[批件号:(B)KY2021113]。
表 1 两组患者一般资料X±S 组别 年龄/岁 体重指数/(kg·m-2) 肿瘤平均直径/cm R.E.N.A.L.评分/分 主干阻断组(33例) 53.76±12.57 24.03±3.65 4.22±1.74 6.33±1.51 选择性分支阻断组(29例) 52.34±10.23 24.22±2.81 3.56±1.80 5.66±0.32 P 0.632 0.817 0.152 0.104 1.2 方法
全息影像CT三维重建:所有患者术前行上腹部增强CT,将CT结果的DICOM数据导入“全息三维医学影像重建系统”,形成三维立体模型,清楚地显示肾脏肿瘤、血管、集合系统等结构的解剖关系。所有手术均由同一位经验丰富的医生于达芬奇机器人系统下操作。手术步骤如下:麻醉成功后,患者取健侧卧位,升高腰桥。于髂嵴腋中线上方约两横指处做一约2 cm横行切口(A点),弯钳分离皮下、肌层,撑开筋膜,用手指钝性分离腹膜后间隙,将扩张器放至此间隙内,充气至600 mL,维持约1 min后放气拔出。在手指引导下,分别于患侧竖直肌与肋缘的交界处(B点),腋前线与肋缘的交界处(C点)切开约0.8 cm切口,B、C点距A点约8 cm,于A点靠腹侧约5 cm处切开一1.2 cm切口(D点),A点置入30°达芬奇机器人镜头。B、C点置入机器人套管,D点作为辅助孔,置入12 mm Trocar。气腹压维持在12~14 mmHg(1 mmHg=0.133 kPa)。清理腹膜外脂肪后切开肾周筋膜,贴近腰大肌,于背侧弓状缘下方约2 cm处寻找到肾动脉主干。根据术前三维重建结果准确判断并定位瘤体滋养分支动脉,游离并充分暴露肾动脉分支。仔细游离肾脏肿瘤。用“哈巴狗”夹阻断供应肿瘤的分支动脉,距肿瘤边缘约5 mm处完整切除肿瘤。再用2-0倒刺线缝合创面,Hem-o-lok结扎夹夹闭缝线末端。开放分支动脉血流,无明显活动性出血后,取出肿瘤,留置负压引流管。
1.3 观察指标
记录患者术中手术时间、热缺血时间、出血量、术后住院时间、并发症、中转主干阻断、中转开放手术等情况,统计两组患者术前、术后3 d行肾功能显像患肾肾小球滤过率(GFR)、术前、术后1个月血肌酐值和抽血估算GFR并进行比较分析。
1.4 统计学方法
采用SPSS 26.0统计学软件进行数据分析。定量资料以X±S表示,组间比较方差齐性采用独立样本t检验,方差非齐性采用非参数检验。以P < 0.05为差异有统计学意义。
2. 结果
62例患者均顺利完成手术,切缘均为阴性,无一例患者中转开放或改行根治性切除术,均未发生大出血、尿瘘、感染、周围脏器损伤等并发症。术后病理结果透明细胞癌40例,乳头状癌2例,嫌色细胞癌5例,囊性肾癌1例,血管平滑肌脂肪瘤12例,肾乳头状腺瘤1例,上皮样血管周细胞性肿瘤1例。根据三维重建结果术前拟定行分支阻断患者均按术前方案顺利实施,无中转改行主干阻断。两组患者手术时间、热缺血时间、出血量、术后平均住院时间等指标比较差异均无统计学意义(表 2)。选择性分支阻断组肾部分切除术后患者术前及术后3 d肾功能显像(ECT)所测的患肾GFR差值、术前及术后1个月血肌酐差值及抽血估算GFR差值均明显小于主干阻断组(表 3)。术后1个月复查CT,均未发现肿瘤复发或转移。
表 2 两组患者围手术期相关指标比较X±S 组别 手术时间/min 热缺血时间/min 出血量/mL 术后住院时间/d 主干阻断组(33例) 124.7±36.4 18.1±4.9 119.1±103.5 4.4±0.7 选择性分支阻断组(29例) 116.9±38.0 16.1±4.6 82.8±57.5 4.7±1.8 P 0.414 0.097 0.099 0.472 表 3 两组患者术前及术后GFR差值、血肌酐差值比较X±S 组别 术前及术后3 d行ECT患肾GFR差值/(mL·min-1) 术前及术后1个月血肌酐差值/(μmol·L-1) 术前及术后1个月抽血估算GFR差值/(mL·min-1) 主干阻断组(33例) 20.0±8.6 10.5±9.7 13.3±9.2 选择性分支阻断组(29例) 13.6±6.8 5.0±6.4 8.2±8.3 P 0.002 0.012 0.028 3. 讨论
随着健康体检观念的深入和B超等检查手段的普及,越来越多的局限性肾癌患者被早期发现。相比于根治性切除术,肾部分切除术术后复发、转移、生存等肿瘤学指标无明显差异[5-6],且可保留正常肾组织,现已被认为是局限性肾癌手术治疗的金标准[1]。肾部分切除术过程中阻断肾动脉时,肾脏供血明显减少,切除肿瘤缝合完毕后恢复血供时,则可能出现肾脏血流再灌注损伤[7-8]。从阻断肾动脉到恢复肾动脉血供这段时间,称之为热缺血时间[9]。热缺血范围越大,时间越长,对肾功能的损害就越大。有学者研究发现,如果热缺血20~30 min,肾功能40%~70%受损,肾功能恢复需6~9 d,当缺血>60 min,肾功能70%~100%受损,l0~14 d后仅能恢复部分肾功能[10]。Becker等[11]甚至认为肾热缺血时间应控制在20 min以内,否则肾功能将出现不可逆的损害。所以肾部分切除术中在保证切缘阴性的基础上尽可能地减少热缺血范围和时间是每个临床医生追求的目标。
肾脏血供丰富,肾动脉从腹主动脉发出后,在进入肾窦前一般分为上、前上、前下、下及后共5支肾段动脉,分别供应肾脏的上段、上前段、下前段、下段及后段肾组织,部分肾段动脉甚至再发出更细的Ⅳ级分支。肾动脉的解剖存在较大变异性[12],副肾动脉为最常见的肾血管变异。肾脏肿瘤可能位于肾脏的某一段或跨越多段肾实质,术中如果能选择性的阻断向肿瘤供血的肾段动脉甚至更细分支,而不影响非肿瘤区域肾脏组织血供,则可以在有效控制术中出血同时又能尽量地减少肾缺血再灌注损伤。吴震杰等[13]通过对343例早期肾癌患者行机器人辅助腹腔镜肾部分切除术,术后随访3~24个月,发现分支阻断组能更好地保护肾功能。Desai等[14]研究同时证实了肾部分切除术中肾动脉分支阻断组相较于主干阻断组,其GFR指标下降百分比在出院时及术后短期随访时均明显偏低。
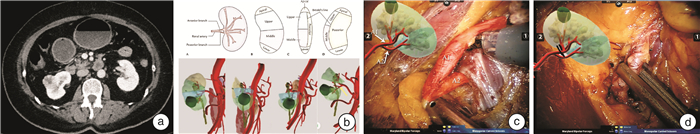
传统二维CT图像可以部分显示肿瘤的位置及血管的分布,但无法清楚地呈现肿瘤所处肾段及肾段动脉走形。术前手术医生根据图像结合临床经验从一系列或者多幅二维图像中自行在脑海中绘制肿瘤的大概位置、肿瘤与集合系统的关系、肾动脉进入肾脏的走形,判断能否行分支阻断,这种经验性的主观判断可能与术中情况不符,发生术中大出血转而改行主干阻断的情况,增加了手术难度,加重了热缺血对肾功能的损害。全息影像三维重建技术是将二维CT的图像数据导入“全息三维医学影像重建系统”,结合人工智能的底层算法,自动进行体绘制引导分割、阈值分割、区域增长、画刷修改、轮廓线修改、三维套索、智能勾画、空洞填充、形态学操作、布尔运算等,并基于分割结果快速生成三维立体模型。该模型可以准确地显示肿瘤位于肾段的位置、肿瘤体积、肾蒂血管及其分支、副肾动脉、瘤体供血动脉、瘤体浸润肾实质深度、瘤体与集合系统的关系,并可在个人移动设备中呈现。术前手术医生可通过缩放、旋转、透明化、组合显示、模拟裁切等工具对重建后的图像进行详细解读,决定手术方式(经后腹腔或经腹腔路径),判断是否能行分支阻断,如何缝合,制定个体化的手术方案。术中手术医生可根据重建图像进行术中导航,在组织分离、切除和缝合过程中随时调整手术方案,以使术中操作更加精确。如图 1所示,三维重建后的肾脏呈半透明状,不同组织结构用不同颜色渲染,可清楚地显示肿瘤与动脉、集合系统的关系。相比于传统阻断肾动脉主干实施肾部分切除术,通过裁剪、旋转、隐身等操作,可发现肿瘤跨越右肾的前下段和下段2部分肾组织,根据这2段的血管供应情况,可以精准地实施选择性肾动脉分支阻断(于黄色箭头处),从而减少肾脏热缺血范围,保护肾功能。Ukimura等[15]研究应用三维数字重建技术,实现了瘤体供血动脉的超选择性阻断甚至“零缺血”状态下肿瘤的完整切除。吕建敏等[16]利用三维智能定性定量分析系统对肾肿瘤进行精准切除,取得了良好的效果。
已有多项研究证实三维重建技术在标准腹腔镜肾部分切除术中的价值[16-18]。机器人手术系统具有出色的视频系统和灵活的操作系统,术者可结合全息影像CT三维重建的清晰可视化技术,术中可反复对比解剖结构与三维图像的特征,并利用机器人系统三维放大的高清手术视野、自由活动且稳定的仿真机械手和直观的器械运动模式等优点,可以更精确地游离并阻断肾动脉分支,更精准地切除肿瘤组织,保留更多的正常肾组织,更确切地缝合肾血管、集合系统和创面切缘,从而最大限度地减少热缺血时间和范围,更好地保护肾脏功能,尤其对于完全内生型肿瘤、T1b或T2a期肿瘤、肾门部肿瘤等复杂性肿瘤优势更加明显。本研究中术后3 d复查ECT,便于发现术后早期肾功能影响的情况,结果表明术后早期较术前有所减小,主干阻断组较选择性分支阻断组患肾差值比较差异有统计学意义。术后1个月复查两组血肌酐水平及抽血估算GFR值,结果表明选择性分支阻断组的患者血肌酐差值及抽血估算GFR差值较主干阻断组要明显偏小,进一步证实选择性分支阻断肾动脉的肾部分切除术能更好地保护肾功能。
综上所述,全息影像CT三维重建技术可清晰立体地显示肾脏肿瘤、血管和周围结构的关系,有助于提高术中行选择性肾动脉分支阻断的肾部分切除术的概率。选择性的肾动脉分支阻断可以更好地保护肾脏功能。由于本研究病例数较少,该结论尚需大样本、前瞻性的对照研究进一步证实。
利益冲突 所有作者均声明不存在利益冲突
-
表 1 两组患者一般资料
X±S 组别 年龄/岁 体重指数/(kg·m-2) 肿瘤平均直径/cm R.E.N.A.L.评分/分 主干阻断组(33例) 53.76±12.57 24.03±3.65 4.22±1.74 6.33±1.51 选择性分支阻断组(29例) 52.34±10.23 24.22±2.81 3.56±1.80 5.66±0.32 P 0.632 0.817 0.152 0.104 表 2 两组患者围手术期相关指标比较
X±S 组别 手术时间/min 热缺血时间/min 出血量/mL 术后住院时间/d 主干阻断组(33例) 124.7±36.4 18.1±4.9 119.1±103.5 4.4±0.7 选择性分支阻断组(29例) 116.9±38.0 16.1±4.6 82.8±57.5 4.7±1.8 P 0.414 0.097 0.099 0.472 表 3 两组患者术前及术后GFR差值、血肌酐差值比较
X±S 组别 术前及术后3 d行ECT患肾GFR差值/(mL·min-1) 术前及术后1个月血肌酐差值/(μmol·L-1) 术前及术后1个月抽血估算GFR差值/(mL·min-1) 主干阻断组(33例) 20.0±8.6 10.5±9.7 13.3±9.2 选择性分支阻断组(29例) 13.6±6.8 5.0±6.4 8.2±8.3 P 0.002 0.012 0.028 -
[1] Ljungberg B, Albiges L, Bensalah K, et al. EAU guidelines on renal cell carcinoma: The 2019 update[J]. Eur Urol, 2019, 75(5): 799-810. doi: 10.1016/j.eururo.2019.02.011
[2] Fujiki T, Nishimura R, Mase S, et al. Accurate detection of renal leukemic involvement in children using 3-D computed tomography modeling[J]. Pediatr Int, 2019, 61(7): 679-687. doi: 10.1111/ped.13907
[3] Elhadidi M, Aldahouk A, Shawky M, et al. Computerguidedcalvarial mono-cortical bone bleaks harvest: a novel approach for three-dimensional alveolar reconstruction of atrophic maxilla[J]. Clin Implant Dent Relat Res, 2019, 21(1): 85-93. doi: 10.1111/cid.12714
[4] Wang Z, Qi L, Yuan P, et al. Application of three-dimensional visualization technology in laparoscopic partial nephrectomy of renal tumor: A comparative study[J]. J Laparoendosc Adv Surg Tech A, 2017, 27(5): 516-523. doi: 10.1089/lap.2016.0645
[5] Liek E, Elsebach K, Göbel H, et al. The Overall Survival Benefit for Patients with T1 Renal Cell Carcinoma after Nephron-Sparing Surgery Depends on Gender and Age[J]. Urol Int, 2018, 100(3): 309-316. doi: 10.1159/000486627
[6] Abdollah F, Arora S, von Landenberg N, et al. Testing the external validity of the EORTC randomized trial 30904 comparing overall survival after radical nephrectomy vs nephron-sparing surgery in contemporary North American patients with renal cell cancer[J]. BJU Int, 2018, 121(3): 345-347. doi: 10.1111/bju.14039
[7] Tiscione D, Cai T, Luciani LG, et al. Sutureless laparoscopic partial nephrectomy using fibrin gel reduces ischemia time while preserving renal function[J]. Arch Ital Urol Androl, 2019, 91(1): 30-34. doi: 10.4081/aiua.2019.1.30
[8] Gershman B, Boorjian SA. When Less Is More: The Comparative Effectiveness of Partial Versus Radical Nephrectomy[J]. Eur Urol, 2021, 79(6): 781-782. doi: 10.1016/j.eururo.2021.03.010
[9] Liang C, Zhu J, Miao C, et al. Protective Effects of the Segmental Renal Artery Clamping Technique on Ischemia-Reperfusion Injury in db/db Diabetic Mice[J]. Biomed Res Int, 2017, 2017: 4763828.
[10] Assimos DG. Anatrophic nephrolithotomy[J]. Urology, 2001, 57(1): 161-165. doi: 10.1016/S0090-4295(00)00920-1
[11] Becker F, Van Poppel H, Hakenberg OW, et al. Assessing the impact of ischaemia time during partial nephrectomy[J]. Eur Urol, 2009, 56(4): 625-634. doi: 10.1016/j.eururo.2009.07.016
[12] Lauder L, Ewen S, Tzafriri AR, et al. Renal artery anatomy assessed by quantitative analysis of selective renal angiography in 1, 000 patients with hypertension[J]. Euro Intervention, 2018, 14(1): 121-128.
[13] 吴震杰, 张宗勤, 徐红, 等. 肾动脉分支阻断与主干阻断在机器人辅助腹腔镜肾部分切除术治疗早期肾癌中的疗效对比[J]. 中华泌尿外科杂志, 2019, 40(5): 328-332. doi: 10.3760/cma.j.issn.1000-6702.2019.05.003
[14] Desai MM, de Castro Abreu AL, Leslie S, et al. Robotic partial nephrectomy with superselective versus main artery clamping: a retrospective comparison[J]. EurUrol, 2014, 66(4): 713-719.
[15] Ukimura O, Gill IS. Imaging-assisted endoscopic surgery: eleveland clinic experience[J]. J Endourol, 2008, 22(4): 803-810. doi: 10.1089/end.2007.9823
[16] 吕建敏, 潘秀武, 干思舜, 等. 三维智能定性定量分析系统在双肾肿瘤精准手术规划、模拟及实施中的应用效果分析[J]. 中华泌尿外科杂志, 2019, 40(5): 356-360. doi: 10.3760/cma.j.issn.1000-6702.2019.05.008
[17] 李新飞, 彭意吉, 余霄腾, 等. 肾部分切除术前CT三维可视化评估标准的初步探究[J]. 北京大学学报(医学版), 2021, 53(3): 613-622. https://www.cnki.com.cn/Article/CJFDTOTAL-BYDB202103031.htm
[18] 魏澎涛, 张寒, 李琦, 等. CT三维重建联合3D打印技术在腹腔镜下保留肾单位手术中的应用[J]. 临床泌尿外科杂志, 2020, 35(4): 304-306. https://www.cnki.com.cn/Article/CJFDTOTAL-LCMW202004011.htm
期刊类型引用(7)
1. 李乔,陈红. 42例全息影像技术引导机器人辅助腹腔镜下肾门部肿瘤切除术的护理配合. 中国临床护理. 2025(01): 17-19 .  百度学术
百度学术
2. 马晨阳,杨少辉,邓科,崔巍. 全息影像CT三维重建技术在结直肠多原发癌外科手术中的应用. 现代实用医学. 2025(01): 56-59 .  百度学术
百度学术
3. 窦科妮,张敏刚,李笑石,耿纪刚,范晓娟,吴永斌. 多层螺旋CT多模态三维重建技术在气管憩室诊断中的效果评价. 中国CT和MRI杂志. 2024(02): 79-81 .  百度学术
百度学术
4. 许剑锋,郭璇骏,李志华,李学松,何志嵩. 三维影像重建在马蹄肾合并肾积水中变异血管分析的临床应用. 临床泌尿外科杂志. 2024(12): 1086-1090 .  本站查看
本站查看
5. 孙嵩,王宜飞,宋平,余曼,方芳. 文物保护视野下馆藏古琴“挖掘价值”理念与实践. 江汉考古. 2024(S1): 135-143 .  百度学术
百度学术
6. 魏梦超,石冰冰,邢宝坤. 肾癌综合诊治的研究进展. 北京医学. 2023(07): 618-622 .  百度学术
百度学术
7. 吴珍珍,张永东,邹晓娟,岳瑾琢,朱茜文. 超声造影联合增强CT在肾肿瘤术前诊断中的应用价值. 海南医学. 2023(19): 2851-2855 .  百度学术
百度学术
其他类型引用(0)
-




 DownLoad:
DownLoad: