Expression of lncRNA PCGEM1 in prostate cancer and its effects on proliferation, apoptosis, invasion, migration and epithelial mesenchymal transition of prostate cancer PC3 cells
-
摘要: 目的 探究lncRNA PCGEM1在前列腺癌组织中的表达情况及lncRNA PCGEM1对前列腺癌PC3细胞增殖、凋亡、迁移、侵袭和上皮间质转化(epithelial mesenchymal transition,EMT)的影响。方法 选取2018年1月—2020年12月在武汉市第三医院确诊的前列腺癌患者35例,分别取其癌组织和癌旁组织,检测其lncRNA PCGEM1表达情况; 体外培养前列腺癌PC3细胞并构建lncRNA PCGEM1沉默细胞系(siPCGEM1)、过表达lncRNA PCGEM1细胞系(lncRNA PCGEM1)和阴性对照(NC); 采用克隆形成实验检测各组细胞增殖并用蛋白质印迹法检测增殖蛋白Ki67和PCNA表达情况; 采用流式细胞术检测细胞凋亡率,采用蛋白免疫印迹(Western blot,WB)检测检测凋亡蛋白Bcl-2和Bax表达情况; 采用Transwell小室实验检测各组细胞侵袭情况并用WB检测E钙粘蛋白(E-cadherin)及波形蛋白(Vimentin)的表达情况。结果 35例患者的癌组织中lncRNA PCGEM1表达水平显著高于癌旁组织(P<0.05);与siPCGEM1组比校,lncRNA PCGEM1和NC组细胞中lncRNA PCGEM1水平、Ki67蛋白相对表达水平、PCNA蛋白相对表达水平、克隆形成率、Bcl-2蛋白相对表达水平、Vimentin蛋白相对表达水平、单位面积侵袭细胞数目显著升高(P<0.05),E-cadherin蛋白相对表达水平和Bax蛋白相对表达水平显著降低(P<0.05);与lncRNA PCGEM1组比较,NC组细胞lncRNA PCGEM1水平、Ki67蛋白相对表达水平、PCNA蛋白相对表达水平、克隆形成率、Bcl-2蛋白相对表达水平、Vimentin蛋白相对表达水平、单位面积侵袭细胞数目显著降低(P<0.05),E-cadherin蛋白相对表达水平和Bax蛋白相对表达水平显著升高(P<0.05)。结论 前列腺癌组织中lncRNA PCGEM1表达水平会异常升高,降低其表达水平可以有效抑制前列腺癌PC3细胞增殖、侵袭并促进其凋亡,同时通过调控EMT过程降低PC3细胞的侵袭能力。
-
关键词:
- lncRNA PCGEM1 /
- PC3细胞 /
- 细胞增殖 /
- 细胞凋亡 /
- 上皮间质转化
Abstract: Objective To investigate the expression of lncRNA PCGEM1 in prostate cancer tissues and the effects of lncRNA PCGEM1 on the proliferation, apoptosis, migration, invasion and epithelial mesenchymal transition (EMT) of prostate cancer PC3 cells.Methods Thirty-five prostate cancer patients diagnosed in Wuhan Third Hospital from January 2018 to December 2020 were selected to collect their cancerous tissues and adjacent tissues. lncRNA PCGEM1 expression was detected. lncRNA PCGEM1 silenced cell line(siPCGEM1), lncRNA PCGEM1 overexpressed cell line(lncRNA PCGEM1) and negative control(NC) were constructed in vitro with prostate cancer PC3 cells. Cell proliferation was detected by clonal formation assay. The expressions of proliferating protein Ki67 and PCNA were detected by western blotting. The apoptosis rate was detected by flow cytometry. The expressions of apoptotic proteins Bcl-2 and Bax were detected by western blotting. Transwell assay was used to detect cell invasion in each group. The expression of E-cadherin and Vimentin was detected by western blot.Results lncRNA PCGEM1 expression level in cancer tissues of 35 patients was significantly higher than that in paracancer tissues (P<0.05). Compared with siPCGEM1 group, the level of lncRNA PCGEM1, the relative expression level of Ki67 protein, the relative expression level of PCNA protein, the cloning rate, the relative expression level of Bcl-2 protein, the relative expression level of Vimentin protein and the number of invading cells per unit area in lncRNA PCGEM1 group and NC group were significantly increased (P<0.05). Compared with siPCGEM1 group, the relative expression level of E-cadherin protein and Bax protein in lncRNA PCGEM1 group and NC group were significantly decreased (P<0.05). Compared with lncRNA PCGEM1 group, the lncRNA PCGEM1 level, the relative expression level of Ki67 protein, the relative expression level of PCNA protein, the clone formation rate, the relative expression level of Bcl-2 protein, the relative expression level of Vimentin protein and the number of invading cells per unit area were significantly decreased in NC group (P<0.05). Compared with lncRNA PCGEM1 group, the relative expression level of E-cadherin protein and Bax protein in NC group were significantly increased (P<0.05).Conclusion lncRNA PCGEM1 expression levels in prostate cancer tissues are abnormally elevated. Reducing the expression level can effectively inhibit the proliferation, invasion and promote apoptosis of adenocarcinoma PC3 cells. The invasion ability of PC3 cells can be suppressed through the regulation of EMT process.-
Key words:
- lncRNA PCGEM1 /
- PC3 cells /
- cell proliferation /
- cell apoptosis /
- epithelial mesenchymal transition
-
前列腺癌(prostatic carcinoma,PCa)是一种常见于老年男性的上皮细胞恶性增生的肿瘤,其发病率位于男性肿瘤第二位[1]。初期经抗雄治疗后PCa患者病情得到较好控制,但治疗一段时间后很容易发展成为转移性激素抵抗性前列腺癌(metastatic hormone resistant prostate cancer,mCRPC),同时在PCa患者体内会有大量肿瘤细胞从肿瘤原发灶脱落并侵袭进入血液循环或淋巴系统中,并且可寄居形成转移灶最终导致患者的死亡[2-3]。目前治疗PCa的方法主要包括手术、化疗、放疗等[4]。近期大量研究发现长链非编码RNA(long non-coding RNA,lncRNA)可以通过多种机制调控肿瘤的进展,部分lncRNAs已被证实可以发挥致癌作用[5]。lncRNA PCGEM1基因位于染色体2q32.3上,lncRNA PCGEM1具有调控肿瘤发展的作用,在许多肿瘤组织中呈现上调的趋势[6]。Xue等[7]研究表明,lncRNA PCGEM1是一种在PCa细胞中特异性高表达的lncRNA,可促进PCa细胞的增殖和迁移。上皮间质转化(epithelial mesenchymal transition,EMT)扮演着重要角色,当细胞间起连接作用的粘连蛋白缺失,上皮细胞黏附分子、E-钙黏蛋白(E-Cadherin)表达下调,角化蛋白基因表达的改变,使得间质化标记物如波形蛋白(Vimentin)表达上调,肿瘤细胞因此获得迁移能力,活动力及侵袭性也大大提高,最后通过释放基质金属蛋白酶等特异性蛋白水解酶溶解细胞基质蛋白进入到人体外周循环系统中[8]。基于此,本研究检测了PCa患者癌组织和癌旁组织中。lncRNA PCGEM1水平,同时培养PC3细胞,分别敲低和升高PCGEM1的表达,检测PCGEM1对C3细胞增殖、凋亡、侵袭、迁移和EMT的影响,以期为PCa患者的治疗奠定理论基础。
1. 材料与方法
1.1 组织标本及主要细胞
选取2018年1月—2020年12月在武汉市第三医院确诊的PCa患者35例,取其癌组织及癌旁组织(>2 cm); PCa PC3细胞购自中国科学院细胞库。
1.2 主要试剂与仪器
Lipofectamine 2000购自Invitrogen公司; Annexin V-FITC/PI细胞凋亡检测试剂盒(货号:40302)购自上海研谨生物科技有限公司; 培养基购自广州威佳科技有限公司; 青霉素钠购自哈药集团制药总厂; Ki67抗体(货号:sc-23900)、PCNA抗体(货号:sc-53407)、Bcl-2抗体(货号:sc-7480)、Bax抗体(货号:sc-20067)、E-cadherin抗体(货号:sc-21791)、Vimentin抗体(货号:sc-373717)均购自美国Santa Cruz Biotechnology公司; Transwell小室购自Corning Corstart公司。
A2生物安全柜(型号:BSC-1100-L Ⅱ)购自日本日立公司; 荧光显微镜(型号:ICX41)购自宁波舜宇仪器有限公司; 高速冷冻离心机(型号:H2500R-2)购自湖南湘仪; 流式细胞仪(型号:Attune NxT)购自赛默飞世尔科技; 二氧化碳培养箱(型号:MCO-18AC)购自松下公司蛋白电泳及转膜仪(型号:1658001)购自Bio-Rad公司。
1.3 方法
1.3.1 细胞培养及传代
PC3的细胞放于37℃的恒温水浴中复苏,取离心机离心,参数设置:1 000 r/min,离心时间5 min。离心完成后加入10%FBS、100 U/mL青霉素和100 U/mL链霉素RPMI1640培养基中,将混合好的细胞放入细胞培养箱中,设置参数:温度37 ℃,CO2浓度:5%待细胞融合到约90%左右后使用PBS冲洗并用胰蛋白酶消化。
1.3.2 细胞转染
培养皿中培养293T细胞使之达到80%~90%的汇合度,在6孔板中各DNA按照比例混合表达质粒,加入50 μL OPTI-MEM缓冲液混匀,取灭菌的EP管内吸取加入15 μL的Lipofectamine 2000和500 μL的OPTI-MEM缓冲液混匀,将DNA稀释液和Lipofectamine 2000稀释液混合静置20 min后加入到预处理的PC3细胞,转染6~8 h后更换培养液,48 h后收集细胞培养上清以2 000 r/min的速度离心3 min,上清病毒转移至标记好灭菌的EP管中,-80℃冰箱储存备用。
1.3.3 RT-PCR检测lncRNA PCGEM1水平
选用胰蛋白酶对组织进行预处理,选用Trizol方法提取细胞总RNA,RNA的纯度和浓度选用分光光度计进行测定,采用反转录合成cDNA链。以此为模板定量PCR仪扩增,选用Actin为内参照基因,采用95 ℃预变性2 min; 使用95 ℃保持8 s,使用58 ℃保持35 s使用,72 ℃保持40 s,共40个循环。目的基因的表达相对值RQ=2-ΔΔCt。
1.3.4 克隆形成实验检测各组细胞增殖
取上述的各组细胞,细胞密度设定为1×103个/mL,放置6孔板中,加入2 mL的细胞培养液后,再向每孔加入0.4 mL的细胞悬液进行培养,14 d后细胞染色并拍照,各组细胞随机选取3个视野进行统计并计算细胞克隆形成率。克隆形成率(%)=(克隆数/所种细胞数)×100 %。
1.3.5 蛋白质印迹法检测蛋白表达水平
取上述的各组细胞,采用恒温离心机离心,参数设置:温度4 ℃,转速1 000 r/min,离心时间10 min,完成离心后依次先后加入裂解液裂及Loading Buffer缓冲液。采用BCA法测定蛋白浓度,采用SDS法对总蛋白进行提取,采用半干法将提取的蛋白转移到PVDF膜上,保持温度为37 ℃,脱脂奶粉调整浓度5%进行封闭2 h,加入Ki67、PCNA、Bcl-2、Bax、E-cadherin及Vimentin蛋白抗体(稀释比例1∶500)。TBS洗净后上机进行检测,实验使用的内参蛋白为GADPH(稀释比1∶1 000),将目的蛋白的灰度值与内参条带灰度值进行相比得出目的蛋白的相对表达水平。
1.3.6 流式细胞仪检测各组细胞凋亡情况
取上述的各组细胞,离心机离心,参数设置为:温度4 ℃,转速1 000 r/min,离心时间5 min; 离心完成后收集细胞,先后加入100 μL Binding Buffer重悬细胞、5 μL Annexin V-FITC、5 μL PI混匀,进行孵育,孵育条件选择:避光时间15 min,完成后再加入400 μL Binding Buffer上机检测各组细胞凋亡情况。
1.3.7 Transwell小室实验检测各组细胞运动能力
取出Transwell小室,在Transwell的上层加入RPMI1640培养基,Transwell小室的下层加入正常培养液。将各组PC3细胞密度调整为1×105个/mL,加入到Transwell小室中,在37 ℃条件下培养24 h,取无菌棉签擦去小室内细胞,选取结晶紫小室下层的细胞进行染色,每组细胞每孔随机选取其中的5个视野进行计数统计,记录单位面积上侵袭细胞数量。
1.4 统计学方法
本研究数据癌组织,癌旁组织和细胞中的lncRNA PCGEM1相对表达量、单位面积侵袭细胞数目统计采用 ±S表示,蛋白质印迹分析采用Image J软件,数据分析和作图软件选择为GraphPad Prism 5,2组之间比较采用t检验,多组之间比较选用单因素方差分析,以P<0.05为差异有统计学意义,本次研究实验至少重复3次。
2. 结果
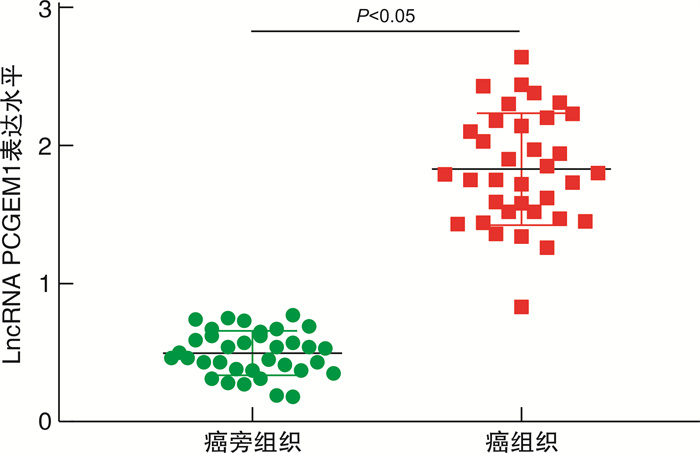
2.1 癌组织及癌旁组织lncRNA
PCGEM1表达水平选取35例患者,PCR检测其癌组织和癌旁组织发现,癌组织中lncRNA PCGEM1表达水平显著高于癌旁组织(P<0.05),见图 1。
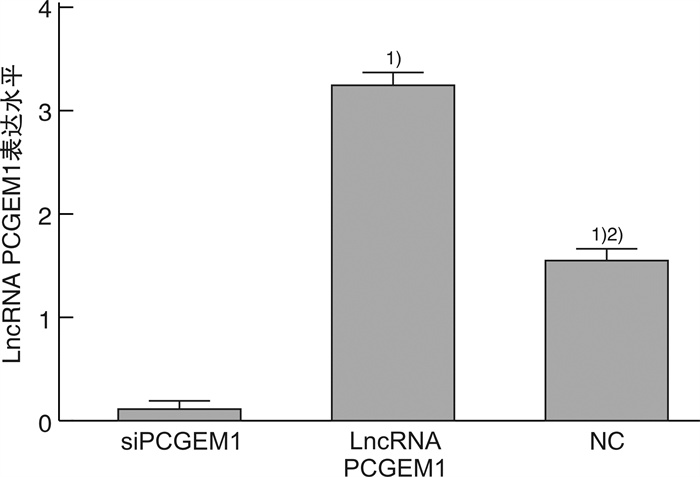
2.2 各组细胞中lncRNA PCGEM1表达水平
PCR检测各组细胞中lncRNA PCGEM1表达水平发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组PCGEM1水平显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组PCGEM1水平显著降低(P<0.05),见图 2。
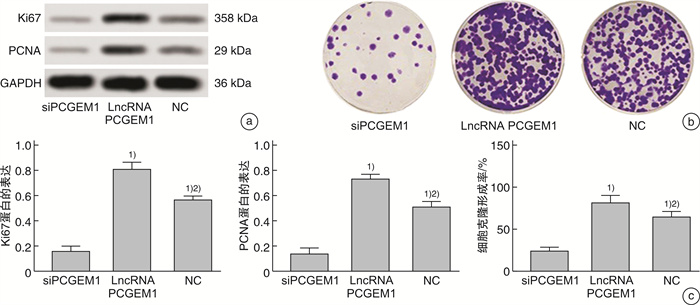
2.3 lncRNA PCGEM1对PC3细胞增殖的影响
蛋白免疫印迹(western blot,WB)检测增殖相关蛋白发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组Ki67蛋白和PCNA蛋白相对表达水平显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组Ki67蛋白和PCNA蛋白相对表达水平显著降低(P<0.05);克隆形成实验检测各组细胞增殖情况发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组细胞克隆形成率显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组细胞克隆形成率显著降低(P<0.05)。见图 3。
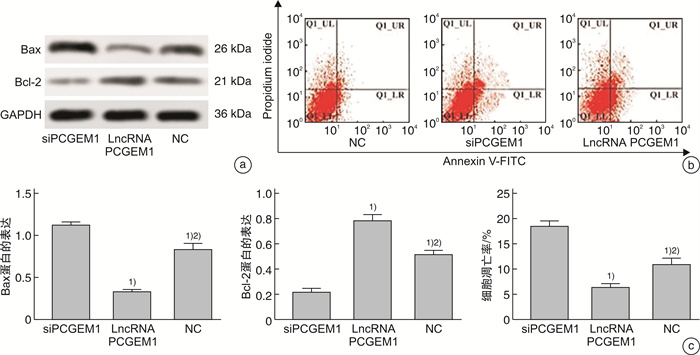
2.4 lncRNA PCGEM1对PC3细胞凋亡的影响
WB检测凋亡相关蛋白相对表达水平发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组Bax蛋白相对表达水平显著降低,Bcl-2蛋白相对表达水平显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组Bax蛋白相对表达水平显著升高,Bcl-2蛋白相对表达水平显著降低(P<0.05)。流式细胞检测各组细胞凋亡水平发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组细胞凋亡率均显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组细胞凋亡率显著降低(P<0.05),见图 4。
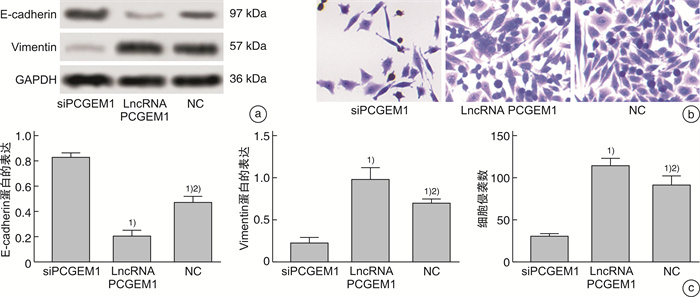
2.5 lncRNA PCGEM1对PC3细胞侵袭、迁移的影响
WB检测EMT相关蛋白相对表达水平发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组E-cadherin蛋白相对表达水平显著降低,Vimentin蛋白相对表达水平显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组E-cadherin蛋白相对表达水平显著升高,Vimentin蛋白相对表达水平显著降低(P<0.05)。Transwell小室实验检测细胞侵袭情况发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组单位面积侵袭细胞数目显著升高(P<0.05);与lncRNA PCGEM1组比较,NC组单位面积侵袭细胞数目显著降低(P<0.05),见图 5。
3. 讨论
lncRNA的表达不同的组织中表达不同,通常在肿瘤组织中lncRNA的表达会出现异常,这些异常表达的lncRNA通常可以通过参与调控细胞生物学特征来发挥类似于癌基因或抑癌基因的功效[9]。lncRNA PCGEM1是近年来研究较多的一个lncRNA,lncRNA PCGEM1位于染色体2q32位点上[10]。PCGEM1是高度前列腺特异性和有吸引力的生物标志物[11]。Piao等[12]研究表明,lncRNA PCGEM1通过诱导血管生成促进侵袭和转移。Wen等[13]研究表明,lncRNA PCGEM1通过调节miR-590-3p/SOX11轴诱调控肺癌细胞增殖和迁移。检测组织中lncRNA PCGEM1的表达水平发现,与癌旁组织比较,癌组织中的lncRNA PCGEM1水平显著升高,这与既往研究相一致。PCa的细胞系较多,主要包括LNCap、PC3、DU145、C4、C4-2等,其中PC3是临床上最常见的一种PCa细胞[14]。因此本研究采用PC3作为实验细胞,构建了lncRNA PCGEM1沉默和过表达的细胞系,分别检测各组细胞的增殖、凋亡和侵袭能力。
细胞增殖是最常见的细胞生物学特征,肿瘤组织细胞一般会出现恶性增殖,其增殖的速率会显著升高,调控增殖的蛋白也会出现对应的变化。目前调控增殖相关的蛋白有很多,其中Ki67和PCNA是常见的调控增殖的重要蛋白[15-16]。Ki67是常见调控细胞增殖的蛋白,Ki67的表达会升高,反之则会减弱[17]。PCNA也是常见调控细胞增殖细胞核抗原,与Ki67相同,在增殖能力强的细胞中PCNA的表达会升高[18]。本研究首先采用克隆形成实验检测了各组细胞的增殖能力,发现与siPCGEM1组比较,lncRNA PCGEM1组和NC组细胞克隆形成率显著升高。与lncRNA PCGEM1组比较,NC组细胞克隆形成率显著降低。为了探究其机制,我们检测了Ki67和PCNA这2种增殖相关蛋白发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组Ki67蛋白和PCNA蛋白相对表达水平显著升高; 与lncRNA PCGEM1组比较,NC组Ki67蛋白和PCNA蛋白相对表达水平显著降低。说明lncRNA PCGEM1可以促进PC3细胞的增殖。
细胞凋亡是一种重要的调控细胞的生物学特征,这种死亡受到相关基因和蛋白的调控[19]。调控凋亡的常见基因有Bcl-2家族基因,在Bcl-2家族中,Bcl-2是抑凋亡基因,Bax是凋亡基因。当Bcl-2表达升高时会拮抗Bax蛋白的表达并抑制细胞的凋亡,反之则会促进细胞的凋亡[20-21]。本研究采用流式细胞仪检测了各组PC3细胞的凋亡情况发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组细胞凋亡率均显著升高; 与lncRNA PCGEM1组比较,NC组细胞凋亡率显著降低。为了探究其作用机制,我们对凋亡相关基因Bcl-2家族蛋白的表达情况进行检测,与siPCGEM1组比较,lncRNA PCGEM1组和NC组中Bax蛋白相对表达水平显著降低,而Bcl-2抗凋亡蛋白相对表达水平显著升高; 与lncRNA PCGEM1组比较,NC组Bax促进凋亡蛋白相对表达水平显著升高,而抗凋亡Bcl-2蛋白相对表达水平显著降低。说明lncRNA PCGEM1基因的表达会抑制细胞的凋亡,这可能与调控Bcl-2家族蛋白相关。
细胞的侵袭和迁移是重要的细胞生物学特征,相比正常组织,肿瘤组织容易扩散,其增殖和侵袭能力也较强,Dongre等[22]研究表明,肿瘤细胞侵袭和迁移能力较强的原因与EMT过程密切相关。Igarashi等[23]研究表明,EMT过程涉及的蛋白主要包括E-cadherin、N-cadherin、Vimentin等。E-cadherin是一种与肿瘤浸润深度、分化程度、转移呈负相关的蛋白。通常当肿瘤细胞的侵袭和迁移能力增强时E-cadherin蛋白的表达水平会降低。Vimentin蛋白是除了E-cadherin蛋白外另一种常见的调节肿瘤细胞EMT过程的蛋白,Vimentin是一种间质细胞来源的骨架蛋白,这种蛋白表达升高会导致细胞变成纤维状且易于游动迁移[24]。本研究采用Transwell小室实验检测各组PC3细胞的侵袭能力发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC单位面积侵袭细胞数目显著升高; 与lncRNA PCGEM1组比较,NC组单位面积侵袭细胞数目显著降低。为探究其作用机制我们检测了EMT相关蛋白相对表达水平发现,与siPCGEM1组比较,lncRNA PCGEM1组和NC组E-cadherin蛋白相对表达水平显著降低,Vimentin蛋白相对表达水平显著升高; 与lncRNA PCGEM1组比较NC组E-cadherin蛋白相对表达水平显著升高,Vimentin蛋白相对表达水平显著降低。说明lncRNA PCGEM1的表达会促进细胞EMT过程,增加细胞的侵袭能力。
综上所述,PCa患者癌组织中lncRNA PCGEM1水平显著高于癌旁组织,升高lncRNA PCGEM1水平会促进PC3细胞的增殖并抑制其凋亡同时促进细胞EMT过程增强细胞侵袭能力。但本研究也存在一定的不足,本研究尚未探究lncRNA PCGEM1调节PC3细胞作用的靶点,也尚未涉及相关信号通路,在后续的实验中将进一步探究lncRNA PCGEM1调节PC3细胞作用的靶点和涉及的相关信号通路。
利益冲突 所有作者均声明不存在利益冲突
-
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin[J], 2016, 66(1): 7-30. doi: 10.3322/caac.21332
[2] de Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial[J]. Lancet, 2010, 376(9747): 1147-1154. doi: 10.1016/S0140-6736(10)61389-X
[3] Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer[J]. N Engl J Med, 2004, 351(15): 1502-1512. doi: 10.1056/NEJMoa040720
[4] Kaplan SA. Re: Impact of 5α-Reductase Inhibitor and α-Blocker Therapy for Benign Prostatic Hyperplasia on Prostate Cancer Incidence and Mortality[J]. J Urol, 2020, 203(5): 856-857. doi: 10.1097/JU.0000000000000763.02
[5] Srikantan V, Zou Z, Petrovics G, et al. PCGEM1, a prostate-specific gene, is overexpressed in prostate cancer[J]. Proc Natl Acad Sci U S A, 2000, 97(22): 12216-12221. doi: 10.1073/pnas.97.22.12216
[6] Chen J, Yuan D, Hao Q, et al. lncRNA PCGEM1 mediates oxaliplatin resistance in hepatocellular carcinoma via miR-129-5p/ETV1 axis in vitro[J]. Adv Clin Exp Med, 2021, 30(8): 831-838. doi: 10.17219/acem/135533
[7] Xue Y, Wang M, Kang M, et al. Association between lncRNA PCGEM1 polymorphisms and prostate cancer risk[J]. Prostate Cancer Prostatic Dis, 2013, 16(2): 139-144, S1. doi: 10.1038/pcan.2013.6
[8] Loriot Y, Bianchini D, Ileana E, et al. Antitumour activity of abiraterone acetate against metastatic castration-resistant prostate cancer progressing after docetaxel and enzalutamide(MDV3100)[J]. Ann Oncol, 2013, 24(7): 1807-1812. doi: 10.1093/annonc/mdt136
[9] Mo M, Ma X, Luo Y, et al. Liver-specific lncRNA FAM99A may be a tumor suppressor and promising prognostic biomarker in hepatocellular carcinoma[J]. BMC Cancer, 2022, 22(1): 11-15. doi: 10.1186/s12885-021-09051-5
[10] Liu SL, Chen MH, Wang XB, et al. lncRNA PCGEM1 contributes to malignant behaviors of glioma by regulating miR-539-5p/CDK6 axis[J]. Aging(Albany NY), 2021, 13(4): 5475-5484.
[11] Walsh AL, Tuzova AV, Bolton EM, et al. Long noncodingRNAs and prostatecarcinogenesis: 'linc'?[J]. Trends Mol Med, 2014, 20(8): 428-436. doi: 10.1016/j.molmed.2014.03.005
[12] Piao H, Zhang J. 2013P Gastric cancer-derived exosomallncRNA PCGEM1 promotes invasion and metastasis by inducing vascular angiogenesis-Science Direct[J]. Ann Oncol, 2020, 31(5): 48-51.
[13] Wen H, Feng H, Ma Q, et al. lncRNA PCGEM1 induces proliferation and migration in non-small cell lung cancer cells through modulating the miR-590-3p/SOX11 axis[J]. BMC Pulm Med, 2021, 21(1): 234. doi: 10.1186/s12890-021-01600-9
[14] Chen W, Cen S, Zhou X, et al. Circular RNA CircNOLC1, Upregulated by NF-KappaB, Promotes the Progression of Prostate Cancer via miR-647/PAQR4 Axis[J]. Front Cell Dev Biol, 2020, 8: 624764.
[15] Wei DM, Chen WJ, Meng RM, et al. Augmented expression of Ki-67 is correlated with clinicopathological characteristics and prognosis for lung cancer patients: an up-dated systematic review and meta-analysis with 108 studies and 14, 732 patients[J]. Respir Res, 2018, 19(1): 150. doi: 10.1186/s12931-018-0843-7
[16] Mrouj K, Andrés-Sánchez N, Dubra G, et al. Ki-67 regulates global gene expression and promotes sequential stages of carcinogenesis[J]. Proc Natl Acad Sci U S A, 2021, 118(10): e2026507118. doi: 10.1073/pnas.2026507118
[17] Stamatiou K, Vagnarelli P. Chromosome clustering in mitosis by the nuclear protein Ki-67[J]. Biochem Soc Trans, 2021, 49(6): 2767-2776. doi: 10.1042/BST20210717
[18] Cardano M, Tribioli C, Prosperi E. Targeting Proliferating Cell Nuclear Antigen(PCNA)as an Effective Strategy to Inhibit Tumor Cell Proliferation[J]. Curr Cancer Drug Targets, 2020, 20(4): 240-252. doi: 10.2174/1568009620666200115162814
[19] Cai J, Yi M, Tan Y, et al. Natural product triptolide induces GSDME-mediated pyroptosis in head and neck cancer through suppressing mitochondrial hexokinase-Ⅱ[J]. J ExpClin Cancer Res, 2021, 40(1): 190-194.
[20] Hu Y, Li H, Li R, et al. Protective effects of Schisandrin B against D-GalN-induced cell apoptosis in human hepatocyte(L02) cells via modulating Bcl-2 and Bax[J]. Bioengineered, 2021, 12(1): 7205-7214.
[21] Flores-Romero H, Ros U, Garcia-Saez AJ. Pore formation in regulated cell death[J]. EMBO J, 2020, 39(23): e105753. doi: 10.15252/embj.2020105753
[22] Dongre A, Weinberg RA. New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer[J]. Nat Rev Mol Cell Biol, 2019, 20(2): 69-84.
[23] Igarashi K, Nishizawa H, Saiki Y, et al. The transcription factor BACH1 at the crossroads of cancer biology: From epithelial-mesenchymal transition to ferroptosis[J]. J Biol Chem, 2021, 297(3): 101032. doi: 10.1016/j.jbc.2021.101032
[24] Usman S, Waseem NH, Nguyen T, et al. Vimentin Is at the Heart of Epithelial Mesenchymal Transition(EMT)Mediated Metastasis[J]. Cancers(Basel), 2021, 13(19): 4985.
期刊类型引用(1)
1. 孙鹤云,杜菲雨,何光远,许梦苗,范光磊. ~(18)F-FDG PET-CT联合MRI对于前列腺癌的临床诊断价值. 中国医药指南. 2024(05): 40-43 .  百度学术
百度学术
其他类型引用(0)
-




 下载:
下载: